
 (1)18电子分子中含有4个原子,其结构式是H-O-O-H或PH3
(1)18电子分子中含有4个原子,其结构式是H-O-O-H或PH3分析 (1)18电子分子中含有4个原子,可能是双氧水或膦;
(2)乳酸在浓硫酸作催化剂、加热条件下发生消去反应生成丙烯酸;
(3)根据原子成键方式知,该有机物结构简式为HO-CH2-CH2-NH-CO-CH2-CH3;
(4)该有机物中含有碳碳双键、羧基和醛基,要证明含有碳碳双键,实现要排除羧基和醛基干扰,碳碳双键和醛基都能和溴水、酸性高锰酸钾溶液反应,但碳碳双键不能和新制氢氧化铜悬浊液反应,所以应该先检验醛基,再酸化,然后用溴水或酸性高锰酸钾溶液检验碳碳双键;
(5)分子式为C8H8的芳香烃为 ,与氢气完全加成后产物为
,与氢气完全加成后产物为 ,
, 中有几种氢原子其一氯代物就有几种.
中有几种氢原子其一氯代物就有几种.
解答 解:(1)18电子分子中含有4个原子,可能是双氧水或膦,分子式为H-O-O-H或PH3,故答案为:H-O-O-H或PH3;
(2)乳酸在浓硫酸作催化剂、加热条件下发生消去反应生成丙烯酸和水,反应方程式为CH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=C-COOH+H2O,
故答案为:CH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=C-COOH+H2O;
(3)根据原子成键方式知,能形成4个共价键的原子是C原子、能形成1个共价键的原子是H原子、能形成3个共价键的是N原子、能形成2个共价键的是O原子,所以该有机物结构简式为HO-CH2-CH2-NH-CO-CH2-CH3,
故答案为:HO-CH2-CH2-NH-CO-CH2-CH3;
(4)该有机物中含有碳碳双键、羧基和醛基,要证明含有碳碳双键,实现要排除羧基和醛基干扰,碳碳双键和醛基都能和溴水、酸性高锰酸钾溶液反应,但碳碳双键不能和新制氢氧化铜悬浊液反应,所以应该先检验醛基,再酸化,然后用溴水或酸性高锰酸钾溶液检验碳碳双键,用新制氢氧化铜悬浊液检验醛基、再用稀硫酸酸化、最后用溴水或酸性高锰酸钾溶液检验碳碳双键,故选①②③或①②④;
(5)分子式为C8H8的芳香烃为 ,与氢气完全加成后产物为
,与氢气完全加成后产物为 ,
, 中有6种氢原子,所以其一氯代物就有6种,故答案为:6.
中有6种氢原子,所以其一氯代物就有6种,故答案为:6.
点评 本题考查有机物结构和性质、官能团检验、一氯代物种类判断等知识点,明确官能团及其性质关系是解本题关键,注意(4)中官能团检验先后顺序及“硫酸”的作用,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
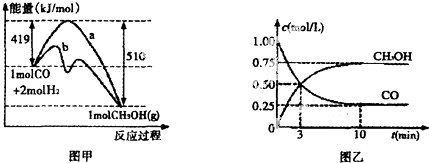
| A. | $\frac{a+b-2c}{4}$kJ | B. | $\frac{a+2b-4c}{8}$kJ | C. | $\frac{b-a-2c}{4}$kJ | D. | $\frac{2b-a-4c}{8}$kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 方法 | 目的 | 离子方程式 | |
| A | 中和法 | 用H2SO4中和碱性废水 | H++OH-═H2O |
| B | 混凝法 | 除去水中悬浮物 | Al3++H2O═Al(OH)3↓+H+ |
| C | 沉淀法 | 除去废水中的Hg2+ | Hg2++Na2S═HgS↓+Na+ |
| D | 氧化法 | 消毒 | Cl2+2OH-═Cl-+ClO-+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:
亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的N2和C2H4体积一定相等 | |
| B. | 凡是能发生银镜反应的物质都属于醛类 | |
| C. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| D. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些孔洞,但CO2会被残留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织成的“笼子”,整体上看呈现出多孔特征,有些类似自然界中的蜂窝结构.下列有关说法正确的是( )
英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些孔洞,但CO2会被残留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织成的“笼子”,整体上看呈现出多孔特征,有些类似自然界中的蜂窝结构.下列有关说法正确的是( )| A. | 该材料是一种新型金属有机材料 | |
| B. | 该材料能捕集CO2,是因为CO2与该材料发生了化学反应 | |
| C. | 该材料捕集11.2L CO2后,增重22g | |
| D. | 可利用该材料将空气中的CO2完全捕集,从而控制温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com