
(18分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+8NH3  7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
(2)已知:2SO2(g)+O2(g)  2SO3(g) ΔH=—196.6 kJ/mol ;
2SO3(g) ΔH=—196.6 kJ/mol ;
2NO(g)+O2(g)  2NO2(g) ΔH=—113.0 kJ/mol ;
2NO2(g) ΔH=—113.0 kJ/mol ;
①则反应NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH 的ΔH=________ kJ/mol。
SO3(g)+NO(g) ΔH 的ΔH=________ kJ/mol。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___ _____。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
③测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=__ ______。
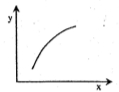
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g),ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g),ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。

该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是____________________________ __。
(本题共18分)
(1)3NO2+H2O=2HNO3+NO(3分) 6.72(3分)
(2)①-41.8(3分) ②B(2分) ③2.67或 (3分)
(3分)
(3)<(2分) 在1.3×104 kPa下,CO转化率已较高,再增大压强,CO转化率提高不大,而生产成本增加,得不偿失(2分)
【解析】
试题分析:(1)二氧化氮与水反应生成硝酸和NO,化学方程式为3NO2+H2O=2HNO3+NO;反应6NO2+8NH3  7N2+12H2O也可处理NO2。1mol二氧化氮转化为氮气时,转移电子的物质的量是4mol,所以当转移1.2 mol电子时,消耗的NO2的物质的量0.3mol,在标准状况下是0.3mol×22.4L/mol=6.72L;
7N2+12H2O也可处理NO2。1mol二氧化氮转化为氮气时,转移电子的物质的量是4mol,所以当转移1.2 mol电子时,消耗的NO2的物质的量0.3mol,在标准状况下是0.3mol×22.4L/mol=6.72L;
(2)①根据盖斯定律,将上式减去下式再除以2可得所求化学方程式的反应热,所以NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH=[(-196.6 kJ/mol)-(-113.0 kJ/mol)]/2=-41.8kJ/mol;
SO3(g)+NO(g) ΔH=[(-196.6 kJ/mol)-(-113.0 kJ/mol)]/2=-41.8kJ/mol;
②A、NO2(g)+SO2(g)  SO3(g)+NO(g)是气体物质的量不变的可逆反应,所以气体的压强不会变化的状态不一定是平衡状态,错误;B、随着反应的进行,二氧化氮的浓度减小,气体的颜色变浅,当气体的颜色不变时,说明反应达到平衡状态,正确;C、因为生成的三氧化硫与NO的物质的量比是1:1,所以SO3和NO的体积比始终不变,不能判断达到平衡状态,错误;D、每消耗1 mol SO3的同时生成1 mol NO2,代表的都是逆反应速率,错误,答案选B;
SO3(g)+NO(g)是气体物质的量不变的可逆反应,所以气体的压强不会变化的状态不一定是平衡状态,错误;B、随着反应的进行,二氧化氮的浓度减小,气体的颜色变浅,当气体的颜色不变时,说明反应达到平衡状态,正确;C、因为生成的三氧化硫与NO的物质的量比是1:1,所以SO3和NO的体积比始终不变,不能判断达到平衡状态,错误;D、每消耗1 mol SO3的同时生成1 mol NO2,代表的都是逆反应速率,错误,答案选B;
③测得上述反应平衡时NO2与SO2的体积比为1∶6,根据气体体积之比等于物质的量之比,设NO2与SO2的起始物质的量为1mol、2mol,二者都消耗xmol,则(1-x):(2-x)=1:6,解得x=0.8,所以生成SO3(g)和NO(g)的物质的量都是0.8mol,则平衡常数K=(0.8×0.8)/(0.2×1.2)=8/3;
(3)温度升高,CO的转化率降低,所以温度升高,平衡逆向移动,则正向是放热反应,所以ΔH<0;根据所给图像可知,在250℃、1.3×104 kPa时,CO的转化率已较高,再增大压强,CO转化率提高不大,而生产成本增加,得不偿失。
考点:考查对氧化还原反应的计算,盖斯定律的应用,化学平衡状态的判断,平衡常数的计算,图像的分析


科目:高中化学 来源:2014-2015学年福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做
A.正极 B.负极 C.阴极 D.阳极
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三上学期期中化学试卷(解析版) 题型:选择题
用NA表示阿佛加德罗常数,下列说法正确的是
A.300 mL 2 mol·L-1的蔗糖溶液中所含分子数为0.6NA
B.在标准状况下,2.8g N2和2.8g CO所含电子数不相等
C.0.2 mol H2O2完全分解转移的电子数为0.2NA
D.在常温常压下,2.24L SO2与O2的混合气体中所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
向FeCl3和BaCl2的混合液中通入过量SO2,有白色沉淀产生。下列说法正确的是
A.白色沉淀为BaSO3 B.该实验表明FeCl3有还原性
C.反应后溶液酸性增强 D.反应后滴加KSCN溶液显红色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
只由两种元素组成的化合物,其中一种元素是氢元素,这类化合物称氢化物。下列物质不属于氢化物的是
A.H2O B.NaH C.H2SO4 D.NH3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省保定市高三12月联考化学试卷(解析版) 题型:选择题
在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B(g)  3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是
3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是
选项 | x | y |
A | 降温 | A的体积分数 |
B | 升高温度 | 混合气体的密度 |
C | 再加入A | B的转化率 |
D | 再加入C | A的体积分数 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省保定市高三12月联考化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中,能大量共存的是
A.含有NaClO的溶液中:K+,NH4+, Fe3+,Br-,SO32-
B.所含溶质为Na2S2O3的溶液:K+、SO42-、NO3-、H+
C.加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-
D.使甲基橙变红的溶液中:Fe2+,MnO4-,Na+,SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省广州市高三上学期期中理综化学试卷(解析版) 题型:选择题
常温下,0.1 mol·L-1的一元酸HA与0.1 mol·L-1的NaOH溶液等体积混合后,所得溶液pH>7,下列说法正确的是
A.混合前一元酸HA的c(H+)=0.1 mol·L-1
B.该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.HA在水溶液中的电离方程式:HA = H+ + A-
D.该混合溶液中:c(A-)+ c(HA)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
25℃、101kPa下,反应2N2O5(g) = 4NO2(g)+O2(g),△H=+56.7 kJ/mol 能自发进行的原因是
A.反应吸热 B.熵增效应大于能量效应
C.熵减小 D.反应放热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com