

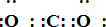 ;写出物质E的电子式:
;写出物质E的电子式: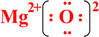 .
.分析 A受热能分解,分解得到等物质的量的B、C、D,且A与碱反应生成D,则A为酸式盐或铵盐,C能和过氧化钠反应,则C为水或二氧化碳,镁条能在B中燃烧,则B为二氧化碳或氧气,因为A受热分解生成B、C、D,则B为二氧化碳,C为水,水和过氧化钠反应生成NaOH和O2,D能在催化剂条件下反应生成H,则D是NH3,G是O2,H是NO,I是NO2,J是HNO3,镁和二氧化碳反应生成氧化镁和碳,C和浓硝酸反应生成二氧化碳、二氧化氮和水,则E是MgO,F是C,通过以上分析知,A为NH4HCO3,以此解答该题.
解答 解:A受热能分解,分解得到等物质的量的B、C、D,且A与碱反应生成D,则A为酸式盐或铵盐,C能和过氧化钠反应,则C为水或二氧化碳,镁条能在B中燃烧,则B为二氧化碳或氧气,因为A受热分解生成B、C、D,则B为二氧化碳,C为水,水和过氧化钠反应生成NaOH和O2,D能在催化剂条件下反应生成H,则D是NH3,G是O2,H是NO,I是NO2,J是HNO3,镁和二氧化碳反应生成氧化镁和碳,C和浓硝酸反应生成二氧化碳、二氧化氮和水,则E是MgO,F是C,通过以上分析知,A为NH4HCO3,
(1)A为NH4HCO3,铵根离子和碳酸氢根离子间含有离子键、铵根离子、碳酸氢根离子中含极性共价键,
故答案为:离子键、极性共价键;
(2)出铜与J为HNO3反应生成硝酸铜、一氧化氮和水,反应的化学方程式为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
(3)反应③是在加热条件下,碳酸氢铵和氢氧化钠反应的离子方程式为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O,
故答案为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O;
(4)物质B为CO2,分子中碳原子和氧原子分别写出两个共价键,二氧化碳的电子式为: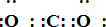 ,E为氧化镁属于离子化合物,电子式为:
,E为氧化镁属于离子化合物,电子式为: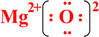 ,
,
故答案为: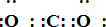 ;
;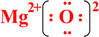 ;
;
(5)水和过氧化钠反应生成氢氧化钠和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,当生成标况下22.4L 氧气时转移电子的物质的量=$\frac{22.4L}{22.4L/mol}$×2×(1-0)=2mol,
故答案为:2.
点评 本题考查了物质转化关系和物质性质的应用,本题涉及铁及其化合物,Al、HNO3、H2SO4等物质的性质应用内容,综合考查考生熟练运用元素化合物知识解决问题的能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中,0族元素的原子半径最小 | |
| B. | 现已发现的ⅡA族元素的单质在常温常压下都是固体 | |
| C. | ⅦA族元素的原子,其半径越大,越容易得到电子 | |
| D. | 所有的主族元素的简单离子所带电荷与其族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.2 mol•L-1硫酸铁溶液中含有的SO42-数为0.6NA | |
| B. | 60 g SiO2晶体中含有2NA个Si-O键 | |
| C. | 1L浓度为1mol•L-1的Na2CO3溶液中含有NA个CO32- | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| B. | 化学反应必然伴随发生能量变化 | |
| C. | 利用生物质能就是间接利用太阳能 | |
| D. | 凡经加热而发生的化学反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
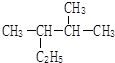 2,3-二甲基戊烷
2,3-二甲基戊烷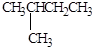

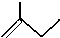 C5H10
C5H10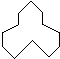 名称是环十二烷,1mol该烃完全燃烧,需消耗氧气18mol.
名称是环十二烷,1mol该烃完全燃烧,需消耗氧气18mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在两种溶液中分别加入少量稀硫酸,加热,再加入碱中和硫酸,再加入银氨溶液,水浴加热 | |
| B. | 测量溶液的导电性 | |
| C. | 向两种溶液中分别滴加硝酸银溶液 | |
| D. | 尝味道 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
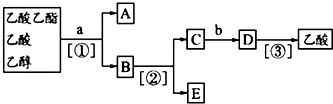
| A. | ①蒸馏 ②过滤 ③分液 | B. | ①分液 ②蒸馏 ③蒸馏 | ||
| C. | ①蒸馏 ②分液 ③分液 | D. | ①分液 ②蒸馏 ③结晶 过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com