
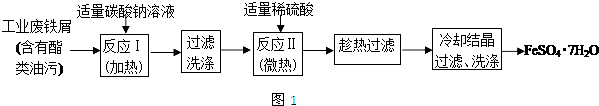

分析 废铁屑中含有酯类油污,Na2CO3为强碱弱酸盐,CO32-水解生成HCO3-和OH-,升高促进CO32-水解,碱促进油脂水解,然后过滤洗涤,加入稀硫酸,发生反应II为Fe+H2SO4=FeSO4+H2↑,趁热过滤、冷却结晶,过滤洗涤得到FeSO4•7H2O;
将补血剂研细,向药片中加入稀硫酸,然后过滤得到沉淀,向滤液中加入双氧水,发生反应2Fe2++H2O2+2H+=2Fe3++2H2O,向溶液中加入过量X溶液生成红褐色沉淀,则X为碱,反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓;将红褐色沉淀灼烧得到红棕色固体Fe2O3,据此分析解答.
解答 解:废铁屑中含有酯类油污,Na2CO3为强碱弱酸盐,CO32-水解生成HCO3-和OH-,升高促进CO32-水解,碱促进油脂水解,然后过滤洗涤,加入稀硫酸,发生反应II为Fe+H2SO4=FeSO4+H2↑,趁热过滤、冷却结晶,过滤洗涤得到FeSO4•7H2O,
(1)Na2CO3为强碱弱酸盐,CO32-水解生成HCO3-和OH-,水解方程式为CO32-+H2O?HCO3-+OH-,油脂在碱性条件下水解生成可溶于水的酸和醇;
盐的水解为吸热反应,升温,促进水解,溶液碱性增强,使反应充分进行,
故答案为:CO32-+H2O?HCO3-+OH-;升温,促进水解,溶液碱性增强,使反应充分进行;
(2)废铁屑中含氧化铁,无需在制备前除去,因为氧化铁和酸反应生成铁盐,铁盐能被Fe还原生成亚铁盐,涉及的离子方程式为Fe2O3+6H+═2Fe3++3H2O、2Fe3++Fe═3Fe2+,
故答案为:Fe2O3+6H+═2Fe3++3H2O、2Fe3++Fe═3Fe2+;
将补血剂研细,向药片中加入稀硫酸,然后过滤得到沉淀,向滤液中加入双氧水,发生反应2Fe2++H2O2+2H+=2Fe3++2H2O,向溶液中加入过量X溶液生成红褐色沉淀,则X为碱,反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓;将红褐色沉淀灼烧得到红棕色固体Fe2O3,
(3)步骤Ⅲ需要100mL1mol/L的稀硫酸,用98%,ρ=1.84g/cm3的浓硫酸配制,配制过程中硫酸的物质的量不变,设需要浓硫酸体积为VmL,则:1.84g/cm3×
98%×VmL=98g/mol×1mol/L×0.1L,解得:V=5.4;
配制一定物质的量浓度的溶液时还需要100mL容量瓶;骤Ⅳ的离子方程式为:Fe3++3OH-=Fe(OH)3↓,
故答案为:5.4;100mL容量瓶;Fe3++3OH-=Fe(OH)3↓;
(4)步骤Ⅴ一系列操作依次是:①过滤②洗涤③灼烧④冷却⑤称量⑥恒重操作,操作⑥恒重后可确保氢氧化铁完全分解成了氧化铁,从而减小误差,
故答案为:灼烧(加热);确保氢氧化铁完全分解成了氧化铁;
(5)ag中含有铁的质量为:m(Fe)=$\frac{112}{160}$×ag=0.7ag,则每片药品中Fe的质量为:$\frac{0.7ag}{10}$=0.07ag,
故答案为:0.07a.
点评 本题考查物质的分离和提纯、物质含量的测定,题目难度中等,明确实验目的、实验原理为解答关键,注意掌握物质分离与提纯方法,试题侧重考查学生的分析、理解能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气的水溶液可以导电,说明氯气是电解质 | |
| B. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| C. | 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 | |
| D. | 氯水中加入红色鲜花,红花褪色,说明溶液中有Cl2存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol磷酸钾中阴离子所带电荷数为NA | |
| B. | 在18g18O2中含有NA个18O原子 | |
| C. | 0.10mol Fe粉与足量水蒸气反应转移的电子数为0.30 NA | |
| D. | 将0.1mol硅酸钠溶于1L水中,所得溶液中含有0.2NA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NaCl 分子 | |
| B. | 质子数为 35、中子数为 45 的溴原子:${\;}_{35}^{45}$ Br | |
| C. | 硫离子的结构示意图: | |
| D. | NH4+ 的电子式: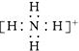 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
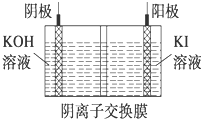 碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中.
碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中.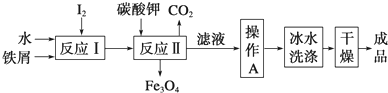
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com