
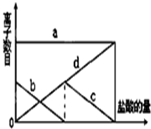
 少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )
少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )| A、a:Cl-b:K+ c:CO32- d:HCO3- |
| B、a:K+ b:CO32- c:Cl- d:HCO3- |
| C、a:K+ b:CO32- c:HCO3- d:Cl- |
| D、a:K+b:HCO3- c:Cl- d:CO32- |


科目:高中化学 来源: 题型:
| A、④③⑤②① |
| B、④③⑤①② |
| C、④⑤③①② |
| D、④⑤③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl |
| B、(NH4)2SO4 |
| C、Ba(OH)2 |
| D、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量前者小于后者 |
| B、Ca(HCO3)2溶液与过量NaOH溶液反应的离子方程式一定是:Ca2++HCO3-+OH-═CaCO3↓+H2O |
| C、H+、Fe2+、NO3-、Cl-能大量共存于同一溶液中 |
| D、同温同浓度的NaOH和澄清石灰水中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g)??2C(g)△H<0,反应达平衡后测得平衡常数为K,此时A的转化率为x.根据以上条件,回答下列问题:
一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g)??2C(g)△H<0,反应达平衡后测得平衡常数为K,此时A的转化率为x.根据以上条件,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com