
| ||
| ||
| ||
| △ |
| ||
| ||
| ||


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属元素从化合态到游离态,该元素被还原 |
| B、非金属元素在化合物中可能呈现正价态 |
| C、金属阳离子被还原不一定得到金属单质 |
| D、金属单质在反应中只能作还原剂,非金属单质只能作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 焦炭 |
| 高温 |
| HCl |
| 573K以上 |
| 精馏 |
| H2 |
| 1357K |
查看答案和解析>>
科目:高中化学 来源: 题型:
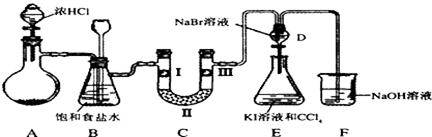
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1kg铜所含原子的数目为dNA | ||
B、一个铜原子所占有的体积为(
| ||
C、一个铜原子的质量为
| ||
D、1dm3铜所含有的原子数为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氧化性:MnO
| ||
| B、还原性:Cl->I->Fe2+ | ||
| C、Fe3+只有氧化性,Fe2+只有还原性 | ||
| D、FeCl3能使淀粉碘化钾溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
| C、钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
| D、氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向SO2的水溶液中滴加紫色的石蕊试液,溶液变红,说明溶液中有H+ |
| B、向SO2的水溶液中滴加Ba(NO3)2溶液,溶液变浑浊,该白色沉淀为BaSO3 |
| C、向品红溶液中不断的通入SO2气体,品红溶液褪色,说明SO2具有漂白性 |
| D、向酸性的KMnO4溶液中通SO2气体,溶液紫色褪去,说明SO2具有还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com