
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是( )
| 溶液组成主要成分 | 对应图像 | 溶液中离子浓度关系 | |
| A | Na2CO3、NaHCO3 | Ⅰ | c(Na+)=c(HCO |
| B | NaHCO3、Na2CO3 | Ⅱ | c(CO |
| C | NaOH、Na2CO3 | Ⅲ | c(OH-)>c(CO |
| D | Na2CO3 | Ⅳ | c(Na+)=c(CO |
科目:高中化学 来源: 题型:
白磷在氧气中燃烧的反应为:P4 + 5O2 == P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol—1、P—O b kJ·mol—1、P=O c kJ·mol—1、O=O d kJ·mol—1。
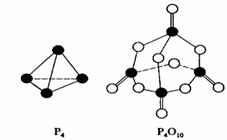
根据图示的分子结构和有关数据下列推断正确的是
A.6a+5d < 4c + 10b B.△H = (4c+12b-6a-5d) kJ·mol—1
C.6a+5d > 4c + 12b D.△H = (6a+5d-4c-12b) kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为:
3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述正确的是
A.放电时,正极区溶液的pH减小
B.放电时,负极反应式为3Zn-6e-+6OH-=3Zn(OH)2
C.充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原
D.充电时,电池的锌电极接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向2 L恒容密闭容器中充入1.0 mol A
和1.0 mol B,反应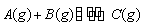 经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A、反应在前5 s的平均速率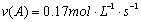
B、保持其他条件不变,升高温度,平衡时 ,则反应的
,则反应的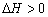
C、相同温度下,起始时向容器中充入2.0 mol C达到平衡时,C的转化率大于80%
D、相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将PCl3(g)和Cl2(g)充入体积
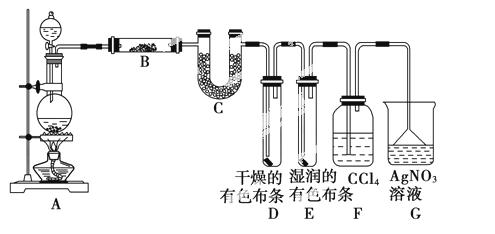
不变的2L密闭容器中发生下述反应:PCl3(g) +Cl2(g) 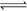 PCl5(g);5min末达到平衡,有关数据如下表。
PCl5(g);5min末达到平衡,有关数据如下表。
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol•L—1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol•L—1) | C1 | C2 | 0.4 |
下列判断不正确的是
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)=0.08 mol•L-1•min-1
C.当容器中Cl2为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol•L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,同时验证氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台已省略),按要求回答问题。
(1)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应,制得的Cl2的体积(标准状况下)总是小于1.12 L的原因是_______________________________________________________________________________。
(2)①装置B中盛放的试剂名称为________,作用是_______________________________________。
装置C中盛放的试剂名称为________,作用是_____________________________________________。
②装置D和E中出现的现象不同说明的问题是________________________________________ 。
。
③装置F的作用是_____________________________________。
④写出装置G中发生反应的离子方程式__________________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在________与________之间(填装置字母序号),装置中应放入________(填写试剂或用品名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4 mol/L、0.1 mol/L向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子的物质的量浓度是( )
A.0.15 mol/L B.0.225 mol/L
C.0.30mol/L D.0.45 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气和氯乙烯都是重要的化工产品,年产量均在1 07t左右。
07t左右。 氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
完成下列填空:
(1)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要_________、________(填写试剂或溶液名称)
(2)实验室用2.00mol/L的盐酸和漂粉精[成分为Ca(ClO)2、CaCl2]反应生成氯气、氯化钙和水,若产生2.24L(标准状况)氯气,发生反应的盐酸为_________m,l。
(3)实验室通常用向上排空 气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
_________________
(4)工业上用电石-乙炔法生产乙烯的反应如下:
CaO+3C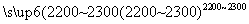 CaC2+CO
CaC2+CO
CaC2+2H2O→HC≡CH↑+Ca(OH)2
HC≡CH↑+HCl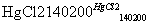 CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖于石油资源。
电石-乙炔法的缺点是___________________、___________ __________。
__________。
(5)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。设计一种以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
___________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com