
(13分)(1)常温下,0.05mol/L硫酸溶液中,c(H+)= mol/L,pH值为 ,水电离的c(H+)= mol/L。如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。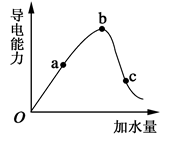
(2)“O”点为什么不导电 。
(3)a、b、c三点的氢离子浓度由小到大的顺序为 。
(4)a、b、c三点中,醋酸的电离程度最大的一点是 。
(5)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择 。
A.加NaCl溶液 B.加热
C.加固体KOH D.加Zn粒
E.加固体CH3COONa F.加水
(6)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是__________________。
A.H+个数 B.c(H+)
C.c(H+)/c(CH3COOH) D.CH3COOH分子数
(1)0.1 mol/L 1 10-13 mol/L (2)因为冰醋酸未电离,无自由移动的离子
(3)c<a<b (4)c (5)B、C、D、E (6)A、C
解析试题分析:(1)0.05mol/L硫酸溶液中c(H+)=0.1 mol/L,pH值为1,水电离的c(H+)为10-13 mol/L。
(2)在O点醋酸没有电离,只有醋酸分子,无自由移动的离子,所以不能导电。
(3)氢离子浓度越大,导电能力越强,所以根据图像可知氢离子浓度的大小顺序为b>a>c。
(4)醋酸是弱酸,存在电离平衡,稀释促进电离,所以c点醋酸的电离程度最大。
(5)根据CH3COOH CH3COO-+H+,加NaCl溶液,平衡不移动c(CH3COO-)不变,加热平衡正向移动,c(CH3COO-)增大,加固体KOH,平衡正向移动,c(CH3COO-)增大,加Zn粒,平衡正向移动,c(CH3COO-)增大,加固体CH3COONa,平衡逆向移动,但c(CH3COO-)增大,加水平衡正向移动,但c(CH3COO-)减小。所以能使c(CH3COO-)增大的措施是BCDE。
CH3COO-+H+,加NaCl溶液,平衡不移动c(CH3COO-)不变,加热平衡正向移动,c(CH3COO-)增大,加固体KOH,平衡正向移动,c(CH3COO-)增大,加Zn粒,平衡正向移动,c(CH3COO-)增大,加固体CH3COONa,平衡逆向移动,但c(CH3COO-)增大,加水平衡正向移动,但c(CH3COO-)减小。所以能使c(CH3COO-)增大的措施是BCDE。
(6)根据CH3COOH CH3COO-+H+,稀释过程中平衡正向移动,H+个数增加,c(H+)减小,c(CH3COO-)减小,CH3COOH分子数减小,根据K=
CH3COO-+H+,稀释过程中平衡正向移动,H+个数增加,c(H+)减小,c(CH3COO-)减小,CH3COOH分子数减小,根据K=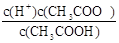 ,c(CH3COO-)减小,所以
,c(CH3COO-)减小,所以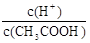 增大。因此选AC。
增大。因此选AC。
考点:电离平衡
点评:本题综合性较强,难度较大,主要要运用好平衡常数。


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 实验编号 | 氨水物质的量浓度 (mol?L-1) |
盐酸物质的量浓度 (mol?L-1) |
混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 2CA3(g)
2CA3(g)| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|
| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(9分)(1)常温下,有0.1mol/L的氨水和0.1mol/L的氢氧化钠溶液,回答下列问题:
①pH 值:氨水 氢氧化钠(填“<” 、“=” 或 “>”)
②两种碱溶液均能与盐酸反应生成盐,等体积的上述两溶液与等浓度的盐酸溶液恰好反应呈中性, 消耗的盐酸多。反应生成的氯化铵溶液呈 (填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示)
③向氨水溶液中加入一定量的盐酸溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为
(选填字母,下同),当测得溶液的pH>7时,溶液中离子的浓度大小为 。
a.c(NH4+)>c(Cl—)>c(OH—)>c(H+) b.c(NH4+) = c(Cl—)>c(OH—) =c(H+)
c.c(Cl—)>c(NH4+)>c(H+)>c(OH—) d.c(NH4+)>c(Cl—)>c(H+)>c(OH—)
(2)向盛有1mL0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L KOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是 ,产生该现象的原因是(用离子方程式和简要文字表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比
是 .
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与
足量的Ba(OH)2溶液反应的离子方程式 .
(3)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)![]() 2CA3(g)
2CA3(g)
ΔH=-92.4 kJ·mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,总容积为1.0 L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol,A2 0.5mol,CA3 0mol B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.5mol/L,A2 0.3mol/L,CA3 0.2mol/L
②若起始加入1.2molC2、1.0molA2,达平衡后C2的浓度为__________mol/L
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将________(填“正向”、“逆向”或“不”)移动.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com