
| A、若满足:c(Cl-)=c(NH4+)>c(OH-)=c(H+),则溶质一定是NH4Cl |
| B、若满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶质一定是NH4Cl和NH3-?H2O |
| C、溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D、若满足:c(NH4+)=c(Cl-),则溶液一定呈中性 |


科目:高中化学 来源: 题型:
| 光照 |
查看答案和解析>>
科目:高中化学 来源: 题型:
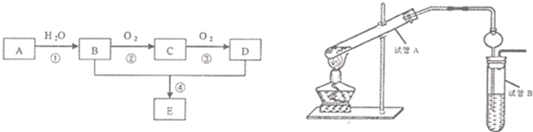
| A、在硬质试管中隔绝空气高温加热固体混合物时,有0.6 g碳参加了反应 |
| B、试管中发生的所有氧化还原反应共转移电子0.15 mol |
| C、反应后试管中剩余的固体混合物的总质量为7.2 g |
| D、反应生成铜和氧化亚铜的总物质的量为0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
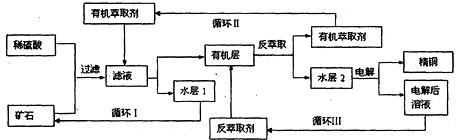
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol/LCH3COONa与0.1mol/LHCl溶液等体积混合(pH<7):c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-) |
| B、0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| C、0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
| D、0.1mol/LNa2CO3与0.2mol/L NaHCO3溶液等体积混合:3c(Na+)=4[c(CO32-)+c(HCO3-)+c(H2CO3)] |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com