
| A、向未知溶液中加入硝酸银溶液,有白色沉淀产生 |
| B、向未知溶液中加入硝酸银溶液,有白色沉淀产生,加入盐酸后.沉淀不消失 |
| C、向未知溶液中加入稀硝酸酸化后,再加入硝酸银溶液,有白色沉淀产生 |
| D、向未知溶液中加入稀盐酸酸化后,再加入硝酸银溶液,有白色沉淀产生 |


科目:高中化学 来源: 题型:
| A、8:5:3 |
| B、10:5:6 |
| C、5:4:6 |
| D、8:3:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所含质子数为(A-n) |
| B、所含中子数为(A-Z+n) |
| C、所含电子数为(Z-n) |
| D、中子数-电子数=A-2Z-n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑤ |
| C、①②③ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| | 操作和现象 | 结论 |
| A | 取某溶液少许,加入盐酸酸化的BaCl2溶液,出现白色沉淀 | 该溶液中一定含有SO42- |
| B | 向纯碱溶液中滴加足量稀盐酸,将产生的气体通入苯酚钠溶液中,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| C | 某溶液中加入盐酸产生能使澄清石灰水变浑浊的气体 | 该溶液一定含有CO32-或SO32- |
| D | 取少量Fe(NO3)2试样加稀硫酸溶解,滴加KSCN溶液,溶液变红色 | 该Fe(NO3)2试样已经变质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
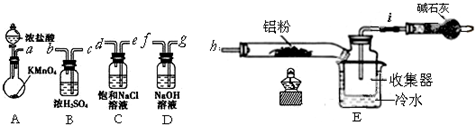
查看答案和解析>>
科目:高中化学 来源: 题型:
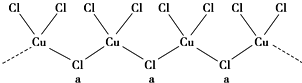
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com