
分析 温度相同时水的离子积常数相同,酸或碱抑制水电离,能水解的盐促进水的电离,根据氢离子浓度或氢氧根离子浓度结合水的离子积常数分析水电离出的氢离子浓度,①HCl是强酸,②Ba(OH)2是强碱,③HF 是弱酸,④NaOH是强碱,酸碱抑制水的电离,水电离出的氢离子减小,⑤NaCl是强酸强碱盐对水的电离无影响,⑥Na2CO3是强碱弱酸盐,溶液中碳酸根离子水解显碱性,促进水的电离.
解答 解:HF是弱电解质,HF溶液中氢离子浓度小于HF浓度,HCl为强酸,完全电离,溶液中氢离子浓度为0.1mol/L,物质的量浓度均为0.1mol/L的酸溶液中,氢离子浓度:③<①=0.1mol/L,氢氧化钠溶液中氢氧根离子浓度=0.1mol/L,氢氧化钡溶液中氢氧根离子浓度=0.2mol/L,酸或碱都抑制水电离,盐酸和氢氧化钠溶液浓度相同,对水的电离抑制程度相同,水电离出氢离子浓度c(H+)<10-7mol/L,液中离子浓度越大,抑制水电离程度越大,氢氧化钡溶液对水的电离抑制程度大,所以由水电离出的c(H+)的大小关系是③>①=④>②,⑤NaCl是强酸强碱盐溶液,溶液呈中性,水电离出的氢离子浓度=10-7mol/L,⑥Na2CO3溶液中碳酸根离子水解溶液显碱性,促进水的电离,水电离出的氢离子浓度c(H+)>10-7mol/L,所以由水电离出来的c(H+)的大小顺序是:⑥>⑤>③>①=④>②,
故答案为:⑥>⑤>③>①=④>②.
点评 本题考查了水电离的影响因素,明确酸和碱抑制水电离、含有弱根离子的盐促进水电离是解本题关键,知道氢离子或氢氧根离子浓度和抑制水电离的关系,难度中等.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:解答题
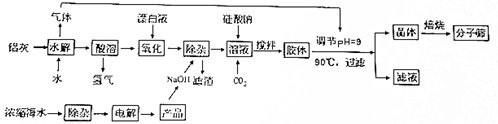
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 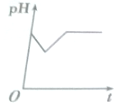 | B. | 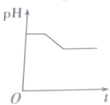 | C. | 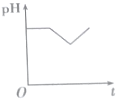 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | 物质的量浓度相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中,c(NH4+)大小顺序为:③>②>① | |
| C. | 等体积,等物质的量浓度的Na2S溶液与NaHS溶液混合后:3c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | |
| D. | 等体积、等物质的量浓度的Na2SO3溶液与HCl溶液混合后:c(H+)+c(H2SO3)═c(SO32-)++c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | B. | H+、K+、HCO${\;}_{3}^{-}$、Ca2+ | ||
| C. | Ba2+、Mg2+、OH-、Cl- | D. | Fe3+、NH${\;}_{4}^{+}$、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
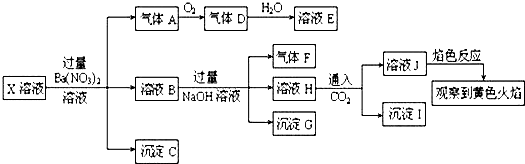
| A. | X中不能确定的离子是Fe3+、A13+、K+、Na+和C1- | |
| B. | 沉淀G中加入盐酸溶解,滴加KSCN溶液显红色,可以确定原溶液中有Fe3+ | |
| C. | 溶液J焰色反应显黄色,则说明原溶液中存在Na+ | |
| D. | 沉淀I一定是A1(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1氨水中,c(OH-)>c(NH4+) | |
| B. | 等体积等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) | |
| C. | 在0.1 mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 0.1 mol•L-1某二元弱酸强碱盐Na2A溶液中,c(Na+)=2c(A2-)+2c(HA-)+2c(H2A) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com