
【题目】用25mL18.4mol/L的浓硫酸与铜共热一段时间后,冷却,过滤除去多余的铜,将滤液稀释到100 mL,所得溶液中SO42-浓度为3mol/L,则此时溶液中CuSO4的物质的量浓度为
A. 0.5mol/L B. 1.6 mol/L C. 1.8 mol/L D. 3mol/L
科目:高中化学 来源: 题型:
【题目】某烃甲与氢气反应后的产物乙为(CH3)2CHCH2CH3,则相关说法不合理的是( )
A.产物乙的系统命名为:2甲基丁烷
B.烃甲可能是2甲基1,3丁二烯
C.0.1 mol产物乙完全燃烧可消耗17.92 L O2
D.烃甲与乙炔可能是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
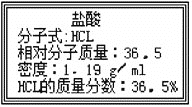
⑴该浓盐酸中HCL的物质的量浓度为 __________mol·L-1 。
⑵取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是(____)
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
⑶某学生欲用上述浓盐酸和蒸馏水配制500ml物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________ml上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
I.用量筒量取浓盐酸进俯视观察凹液面(______)
II.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水(______)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合金的说法正确的是 ( )
①合金至少含两种金属
②合金中元素以化合物形式存在
③合金中一定含金属
④合金一定是混合物
⑤铁锈是一种铁合金
A.①②B.②③⑤C.③④D.③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m1g铜铝合金投入到1 L含H2SO4和HNO3的混合溶液中,合金完全溶解后只生成VL —氧化氮气体(标准状况),向反应后的溶液中逐滴加入1mol/L NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如下图所示。下列说法中不正确的是:
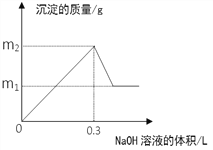
A. 2c(H2SO4) + c(HNO3) = 0.8 mol·L-1
B. m2—m1=5.1
C. 原合金中铝的质量分数为34.7%
D. V = 2.24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制1mol/LNaOH溶液240ml,请回答:
(1)需称取NaOH固体____________g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小___________(填字母),并在下图中选出能正确表示游码位置的选项_________(填字母)。

(2)选用的主要玻璃仪器除烧杯、玻璃棒外还有________________________。
(3)下列操作的顺序是(用序号表示)_________________。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)下列情况对所配制的NaOH溶液浓度有何影响?(用“偏大”“偏小”“无影响”填写)
①容量瓶用蒸馏洗涤后残留有少量的水________________
②将热的溶液直接移入了容量瓶________________
③定容时,仰视容量瓶的刻度线________________
④转移溶液时,玻璃棒的下端在容量瓶的刻度线以上________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是:
A. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C. 滴定时,左手控制滴定管活塞,右手握持锥形瓶边滴边振荡,眼睛注视滴定管中的液面
D. 称量时,称量物质放在称量纸上,置于托盘天平的左盘,砝码放出托盘天平的右盘中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据以下背景资料,回答下列问题:
Ⅰ、不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金。
Ⅱ、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。
Ⅲ、砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
Ⅳ、K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH![]() Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(1)镍元素基态原子的电子排布式为_________________。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为___________,碳原子的轨道杂化类型为_________,所含σ键与π键的数目之比为______________________。
(3)AsCl3分子的立体构型为_____________,铁原子中有_________个未成对电子。
(4)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的原子是_____。
(5)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(6)某镍白铜合金的立方晶胞结构如图所示。
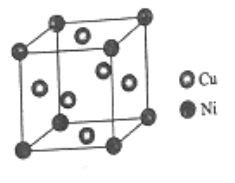
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com