
| A. | 洗净的容量瓶中残留少量的蒸馏水 | B. | 溶解NaOH的烧杯未洗净 | ||
| C. | 称量NaOH时使用称量纸 | D. | 定容时俯视刻度线 |
分析 分析不当操作对溶质物质的量和溶液体积的影响,依据c=$\frac{n}{V}$进行误差分析.
解答 解:A.洗净的容量瓶中残留少量的蒸馏水,对溶质物质的量和溶液体积都不会产生影响,溶液的浓度不变,故A不选;
B.溶解NaOH的烧杯未洗净,导致溶质的物质的量偏小,所配溶液的浓度偏低,故B不选;
C.称量NaOH时使用称量纸,NaOH具有吸湿性,实际质量偏小,所配溶液的浓度偏低,故C不选;
D.定容时俯视刻度线,导致溶液的体积偏小,所配溶液的浓度偏高,故D选;
故选D.
点评 本题考查了配制一定物质的 浓度溶液的误差分析,准确判断不当操作对溶质的物质的量和溶液体积的影响是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=c |
| A. | 甲中:若a=7,则HA是强酸 | |
| B. | 乙中:若b≠0.2,则c(A-)≠c(Na+) | |
| C. | 丙中:若HA是弱酸,则c(A-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 丁中:若c=9,则c(OH-)-c(HA)=10-9mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 和C2H6 | B. | CH4和C3H6 | C. | C3H8和C2H4 | D. | CH4 和C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 锌是负极,发生氧化反应 | |
| B. | 锌的质量减少6.5g,外电路中通过0.4mol电子 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液中n(OH-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 数目为NA的一氧化碳分子和0.5 mol甲烷的质量比为7:4 | |
| B. | 标准状况下,22.4 L水中含有水分子的数目为NA | |
| C. | 14 g N2中含有电子的数目为14NA | |
| D. | 2.3g Na完全反应时,转移电子的数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 纤维编号 | ① | ② | ③ |
| 灼烧时的气味 | 特殊气味 | 烧纸气味 | 烧焦羽毛气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
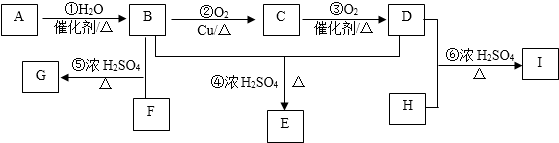
 .
.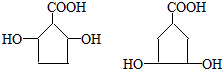 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
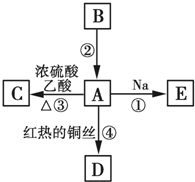 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示: CH3COOC2H5+H2O
CH3COOC2H5+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com