
分析 根据原子或离子的核外电子排布确定元素的质子数,可确定元素的种类,
(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,根据构造原理可知,核外有4或6个电子;
(2)B-和C+的电子层结构都与氩相同,分别为Cl和K元素;
(3)D3+的3d亚层为半充满,为Fe元素,原子序数为26,根据构造原理写出电子排布式;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,应为Cu,原子序数为29,根据构造原理写出电子排布式;
(5)F元素的原子最外层电子排布式为nsnnpn+1,s能级最多排2个电子,该元素排列了p能级说明s能级已经填满,所以n=2,则该元素最外层电子排布式为2s22p3,p轨道能量大于s轨道电子能量.
解答 解:(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,根据构造原理可知,核外有6或8个电子,所以该元素为C或O,
故答案为:C或O;
(2)B-和C+的电子层结构都与氩相同,分别为Cl和K元素,
故答案为:Cl;K;
(3)D3+的3d亚层为半充满,其基态原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2,为Fe;
故答案为:Fe;1s22s22p63s23p63d64s2或[Ar]3d64s2;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,应为Cu元素,
故答案为:Cu;1s22s22p63s23p63d104s1或[Ar]3d104s1;
(5)F元素的原子最外层电子排布式为nsnnpn+1,s能级最多排2个电子,该元素排列了p能级说明s能级已经填满,所以n=2,则该元素最外层电子排布式为2s22p3,则该元素是N元素,根据构造原理知该元素中能量最高的电子是2p电子.
故答案为:2;2p.
点评 本题考查元素推断、核外电子排布等,题目难度不大,注意掌握原子核外电子的排布规律,以此推断元素,注意基础知识的理解掌握.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
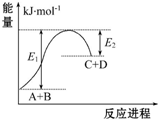
| A. | 该反应为放热反应 | |
| B. | 该反应吸收的能量为(E1-E2) | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应只有在加热条件下才能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com