
| A. | HCl-→SO3-→石墨-→液氧 | B. | NaCl-→乙醇-→铁-→空气 | ||
| C. | 蔗糖-→CuSO4-→氮气-→波尔多液 | D. | KCl-→NaNO3-→氯气-→石灰水 |
分析 电解质是指在水溶液里或熔化状态下能够导电的化合物;非电解质是指在水溶液里和熔化状态下都不能够导电的化合物;单质是同种元素组成的纯净物;混合物是由不同物质组成的,据此可以分析各个选项中各种的所属类别.
解答 解:A、HCl、SO3、石墨、液氧分别属于电解质、非电解质、单质、单质,故A错误;
B、NaCl、乙醇、铁、空气分别属于电解质、非电解质、单质、混合物,故B正确;
C、蔗糖、CuSO4、氮气、波尔多液分别属于非电解质、电解质、单质、混合物,故C错误;
D、KCl、NaNO3、氯气、石灰水分别属于电解质、电解质、单质、混合物,故D错误;
故选:B.
点评 本题主要考查了有关概念,应抓住概念的要点来判断物质的类别,了解常见物质的组成.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2g | B. | 4g | C. | 8g | D. | 10g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
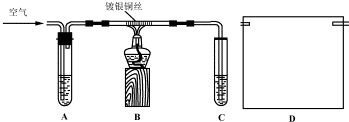
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
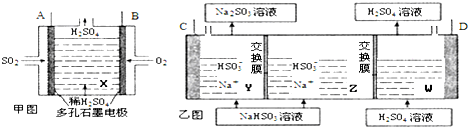
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
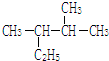 用系统命名法命名:2,3-二甲基戊烷;
用系统命名法命名:2,3-二甲基戊烷;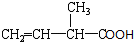 含氧官能团的名称是羧基;
含氧官能团的名称是羧基;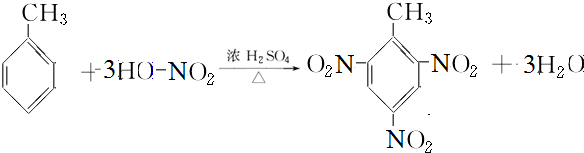 ;
; ;
;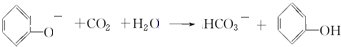 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | X | ||
| Y | Z |
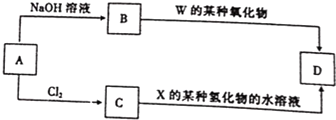
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
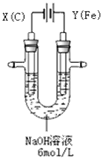 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com