
分析 (1)H++OH-=H2O、n=cv,根据强酸和强碱完全反应时,强酸和强碱的物质的量之间的关系进行计算;
(2)m=nM,硫酸和氢氧化钡反应离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,根据方程式进行计算.
解答 解:(1)pH═12的Ba(OH)2溶液中:c(OH-)=$\frac{{K}_{W}}{C({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-12}}$=0.01mol/L,pH=2的盐酸,c(H+)=0.01mol/L,Ba(OH)2溶液与盐酸两者恰好完全反应,
H++OH-=H2O,则根据公式n=cv可知:0.01mol/L×V1=0.01mol/L×V2,则两溶液的体积比V1:V2=1:1,
故答案为:1:1;
(2)pH=2的硫酸,c(H+)=0.01mol/L,C(H+)=2c(H2SO4)=0.01mol/L,c(H2SO4)=C(SO42-)=0.005mol/L,Ba(OH)2溶液与硫酸两者恰好完全反应,Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,则根据公式n=cv可知:0.01mol/L×V1=0.01mol/L×V3,则两溶液的体积比V1:V3=1:1,n(BaSO4)=n[Ba(OH)2]=0.01mol/L×V1,生成硫酸钡沉淀的物质的量为:0.01V1mol,所得沉淀的质量为m=nM=0.01V1mol×233g/mol=2.33V1g,
故答案为:1:1;2.33V1g.
点评 本题考查学生强酸和强碱混合后有关溶液的pH的计算问题,解题的关键是找好强酸和强碱之间的量的关系,然后列等式进行计算,题目难度中等.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:推断题
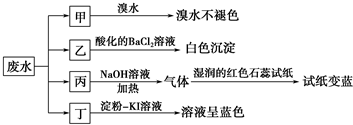
| 阳离子 | Na+、Mg2+、X |
| 阴离子 | Cl-、SO32-、Y、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在浓硫酸作催化剂时,可与硝酸发生反应 | |
| B. | 分子中含有三个C-C键和三个C=C键 | |
| C. | 分子中C、H元素的质量比为6:1 | |
| D. | 能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
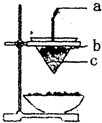
| A. | ①②④ | B. | ①②③ | C. | ②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com