
【题目】以铝土矿(主要成分为Al2O3,含SiO2和铁的氧化物等杂质)为原料制备铝与硫酸亚铁,工艺流程如图所示:请回答下列问题:
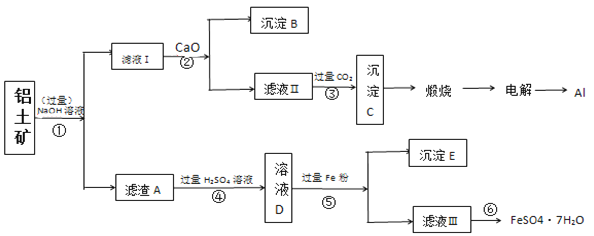
(1)步骤①中提高碱浸速率的方法_______。
(2)滤液Ⅰ中主要的阴离子是______,沉淀B的化学式____,步骤③的离子方程式:____。
(3)步骤⑤加入过量的铁粉的目的___(用离子方程式解释)
(4)检验滤液Ⅲ中的金属阳离子的方法是:_____。
(5)滤液Ⅲ经过________,_______,过滤得到硫酸亚铁晶体,过滤时需要的玻璃仪器有___(填标号)。
(6)利用上述工艺流程测定铝土矿中铁元素的质量分数,取10g样品,最终得到5.56g的FeSO4·7H2O晶体,该铝土矿中铁元素的质量分数_____。
【答案】粉碎铝土矿(升高温度) AlO2-、SiO32- CaSiO3 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Fe+2Fe3+=3Fe2+ 加入KSCN溶液,无现象,再通入Cl2 ,产生血红色的络合物 蒸发浓缩 冷却结晶 BD 11.2﹪
【解析】
(1)步骤①中提高碱浸速率的方法有升高温度、提高碱液的浓度或将铝土矿粉碎;
(2)铝土矿中的Al2O3和SiO2与过量NaOH溶液反应生成,NaAlO2和Na2SiO3,滤液Ⅰ中主要的阴离子是AlO2-、SiO32-,滤液Ⅰ中加CaO用来除去SiO32-,沉淀B的化学式为CaSiO3,步骤③向含有AlO2-的溶液通入过量CO2,将AlO2-转化为Al(OH)3沉淀,离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
答案为:AlO2-、SiO32-;CaSiO3;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
(3)滤渣A为铁的氧化物,加硫酸进行溶解,将固体铁氧化物转化为铁离子和亚铁离子;步骤⑤加入过量的铁粉的目的是将溶液中的Fe3+转化为Fe2+为制备FeSO4·7H2O做准备,离子方程式:Fe+2Fe3+=3Fe2+;答案为:Fe+2Fe3+=3Fe2+
(4)滤液Ⅲ中的金属阳离子为Fe2+,检验Fe2+的方法为加入KSCN溶液,无现象,再通入Cl2 ,产生血红色的络合物,可证明滤液Ⅲ中含有Fe2+;答案为:加入KSCN溶液,无现象,再通入Cl2 ,产生血红色的络合物
(5)由硫酸亚铁溶液转为硫酸亚铁晶体,经过操作为蒸发浓缩、冷却结晶,过滤时需要的玻璃仪器有烧杯、玻璃棒、漏斗。答案为:BD;
(6)最终得到5.56g的FeSO4·7H2O晶体,n(Fe)=n(FeSO4·7H2O)=![]() =0.02
=0.02![]() ,m(Fe)= 0.02
,m(Fe)= 0.02![]() ×56
×56![]() =1.12g,该铝土矿中铁元素的质量分数=
=1.12g,该铝土矿中铁元素的质量分数=![]() ;
;
答案为:![]() ;
;


科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素的基态价电子排布式为_____________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______________,提供孤电子对的成键原子是_____________。
③氨的沸点_________(填“高于”或“低于”)膦(PH3),原因是__________________;氨是_________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______________键形成的晶体。
(4)某镍白铜合金的立方晶胞结构如图所示。
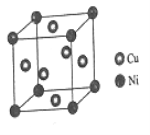
①晶胞中铜原子与镍原子的数量比为___________。
②若合金的密度为dg/cm3,晶胞边长a=______________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其他条件不变,C的物质的量分数(C)和温度(T)或压强(P)关系如图,其中满足关系图的是( )
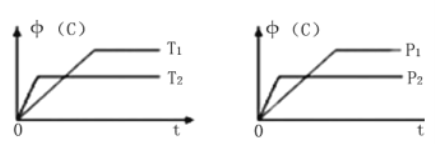
A. 3A(g)+B(s)![]() C(g)+D(g);△H<0
C(g)+D(g);△H<0
B. A(g)+B(s)![]() C(g)+D(g);△H<0
C(g)+D(g);△H<0
C. A(g)+B(s)![]() 2C(g)+D(g);△H>0
2C(g)+D(g);△H>0
D. A(g)+2B(s)![]() C(g)+3D(g);△H>0
C(g)+3D(g);△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要250 mL 0.5 moL/L的稀硫酸溶液,现用密度为1.84 g/mL,质量分数为98%的浓硫酸配制。请回答下列问题。
(1)下列仪器中,用不到的是__________。
A.250 mL容量瓶 B.500 mL容量瓶 C.50 mL量筒 D.10 mL量筒
(2)若要进行配制,除上述仪器外,尚缺少的仪器或用品是_______________________。
(3) 容量瓶上除有刻线和容量规格外还应标有温度,容量瓶在使用前必须进行的操作是:________。
(4)人们常将配制过程简述如下:①冷却;②洗涤烧杯中的液体;③量取;④溶解;⑤定容;⑥摇匀;⑦移液。其正确的操作顺序是________________________ (填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解饱和食盐水的原理示意图如图所示。下列说法正确的是 ( )

A. M为负极
B. 通电使氯化钠发生电离
C. c出口收集到的物质是氯气
D. 电解一段时间后,阴极区pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按指定要求完成下列问题。
(1)在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,被水还原的BrF3的物质的量是___。
(2)已知砒霜As2O3与Zn可发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
①请用双线桥法标出电子转移的方向和数目___。
②若生成0.2molAsH3,则转移的电子数为___。
(3)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,制备ClO2有以下两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①方法一中氧化剂与还原剂的物质的量之比为___。
②若两种方法制备得到相同条件下相同体积的ClO2气体,则两种方法中消耗的还原剂质量之比是___。
③Cl2与ClO2均用作水处理剂,若它们中的氯元素均被还原为Cl-,则相同质量的ClO2是Cl2消毒效率的___倍(消毒效率:等质量两种物质所转移电子的物质的量之比)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用圆表示 3 种物质之间的关系(见如图),其中Ⅰ为大圆,Ⅱ和Ⅲ是包含在大圆之内 的 2 个小圆。符合其关系的是( )
Ⅰ | Ⅱ | Ⅲ | |
A | 脱氧核糖核酸 | 核糖核酸 | 核酸 |
B | 染色体 | DNA | 脱氧核糖 |
C | 固醇 | 胆固醇 | 维生素 D |
D | 蛋白质 | 酶 | 性激素 |
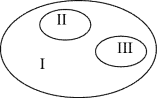
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含![]() 的质量计),某研究小组同学设计了如下实验方案。
的质量计),某研究小组同学设计了如下实验方案。
I.称取样品W g;
II.向样品中加人足量稀硫酸:
III.将II中产生的![]() ,用足量
,用足量![]() 溶液吸收;
溶液吸收;
IV.将III所得硫酸溶夜用氢氧化钠溶液滴定;
V.数据处理。
(1)![]() 是一种食品添加剂。写出
是一种食品添加剂。写出![]() 与稀
与稀![]() 反应的离子方程式:____________
反应的离子方程式:____________
(2)步骤中H2O2的作用是 __________________________
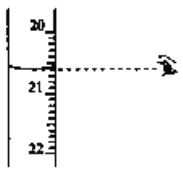
(3)步骤N中可选用的指示剂为__________。下图显示滴定终点时,滴定管(量程为25mL)读数为_______________。
(4)步骤IV中消耗![]() 溶液V mL,则1 kg样品中含
溶液V mL,则1 kg样品中含![]() 的质量是__________g(用含W、V的代数式表示)。
的质量是__________g(用含W、V的代数式表示)。
(5)此实验方案测得亚硫酸盐含量偏低,步骤II会产生该误差,请说明理由。(写出2条)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是
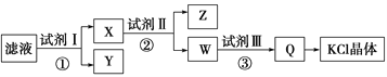
A. 起始滤液的pH=7
B. 试剂Ⅰ为Ba(NO3)2溶液
C. 步骤②中加入试剂Ⅱ的目的是除去Ba2+
D. 图示的步骤中必须要经过2次过滤操作
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com