
【题目】如图所示是分离混合物时常用的仪器,回答下列问题:
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]() E.
E. 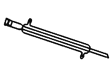
(1)写出仪器 C、E 的名称_____ 、_____。
(2)分离以下混合物应该主要选用上述什么仪器(填字母符号)a.粗盐和泥沙:____b.花生油和水:____
(3)下列实验与物质微粒大小无直接关系的是_____
A.过滤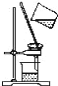 B.渗析
B.渗析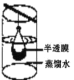 C.萃取
C.萃取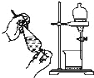 D.丁达尔效应
D.丁达尔效应
【答案】分液漏斗 冷凝管 B C C
【解析】
(1)仪器 C用于分离分层的液体,E 用于冷凝蒸气;
(2) a.粗盐和泥沙,为易溶和难溶固体的混合物,可采用过滤操作分离;b.花生油和水,为不互溶的液体混合物,可采用分液法分离;
(3) A.过滤,需使用滤纸,滤纸的孔隙允许离子和分子通过,而不允许固体颗粒通过;
B.渗析,使用半透膜,半透膜的孔隙允许溶液中的离子和水分子通过,而不允许胶体粒子通过;
C.萃取,使用分液漏斗,利用溶解性和密度的差异,先将下层液体沿分液漏斗颈流出,后将上层液体沿分液漏斗上口倒出;
D.丁达尔效应,是利用胶体粒子比溶液中离子和分子颗粒直径大,会对光发生散射作用,实现溶液和胶体的区分。
(1)仪器 C、E 的名称分别为分液漏斗、冷凝管。答案为:分液漏斗;冷凝管;
(2)a.粗盐和泥沙为易溶和难溶固体混合物,常采用过滤操作分离,故选择漏斗B;b.花生油和水为不互溶液体混合物,常采用分液法分离,故选择分液漏斗C。答案为:B;C;
(3) A.过滤,需使用滤纸,滤纸的孔隙允许离子和分子通过,而不允许固体颗粒通过,A不合题意;
B.渗析,使用半透膜,半透膜的孔隙允许溶液中的离子和水分子通过,而不允许胶体粒子通过,B不合题意;
C.萃取,使用分液漏斗,利用溶解性和密度的差异,先将下层液体沿分液漏斗颈流出,后将上层液体沿分液漏斗上口倒出,C符合题意;
D.丁达尔效应,是利用胶体粒子比溶液中离子和分子颗粒直径大,会对光发生散射作用,实现溶液和胶体的区分,D不题意。综合以上分析,只有C符合题意。答案为C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】钴蓝(化学式Al2CoO4)是一种耐热、耐光、耐酸、耐碱腐蚀的蓝色颜料。某企业利用含铝锂钴废料(铝箱、CoO和Co2O3、Li2O)制备钴蓝的工艺流程如下:
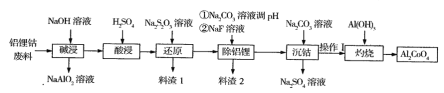
回答下列问题:
(1)碱浸时要有防火、防爆措施,原因是______,操作I的内容是_______。
(2)在实验室模拟工业生产时,也可用盐酸酸浸出钴,但实际工业生产中却不用盐酸,请 从反应原理分析不用盐酸浸出钴的主要原因___。
(3)写出“还原”过程中反应的离子方程式____。
(4)料渣2的主要成分是A1(OH)3 、____,写出灼烧时反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
Ⅰ.pH=2 时, NaNO2 溶液只能将 I-氧化为 I2,同时生成 NO;
Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl;
Ⅲ.I2在碱性溶液中反应生成I-和IO3-。
(1)反应①的离子方程式_____。
(2)方案甲中,根据 I2的特性,分离操作 X 的名称是_____。
(3)Cl2、酸性 KMnO4 等都是常用的强氧化剂,但该工艺中氧化卤水中的 I-却选择了价格较高的NaNO2,原因是_____。
(4)方案乙中,已知反应③过滤后,滤液中仍存在少量的 I2、I-、IO3-。 请检验滤液中的I-,将实验方案补充完整。实验中可供选择的试剂:稀 H2SO4、淀粉溶液、Fe2(SO4)3 溶液。
A.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。
B._____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的铜和 Fe2O3 的混合物中加入 200mL1.5 mol·L-1的稀硫酸,完全反应后固体无剩余,得到的溶液中只有两种溶质,假设反应前后溶液体积不变,则下列说法正确的是( )
A.原混合物中 Cu 和 Fe2O3 的质量之比为 1∶2
B.反应后的溶液中 CuSO4 的物质的量的浓度为 1mol/L
C.若用 CO 还原等质量的原混合物,充分反应后,质量将减少 4.8 克
D.该反应过程均发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是( )
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是( )
A.若降温,该反应的平衡常数增小
B.吸收y mol H2只需1 mol MHx
C.容器内气体密度保持不变时则反应达到了平衡状态
D.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质 A、B 和气体甲、乙、丙以及物质 C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
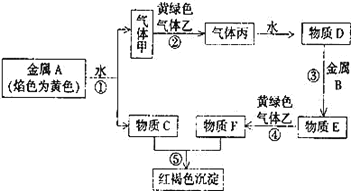
请回答下列问题:
(1) A 的化学式为_____,F 的化学式为_____;
(2) 写出 C 溶液与 Al 反应的离子方程式_____。
(3) 写出 C 溶液与黄绿色气体乙反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=8.0×10-38,Kb(NH3·H2O)=1.8×10-5,下列叙述中不正确的是
A.25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀
B.25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂
C.25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强
D.25℃时,![]() +H2O
+H2O![]() NH3·H2O+H+的平衡常数为5.6×10-10
NH3·H2O+H+的平衡常数为5.6×10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是
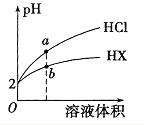
A. a、b两点: c(X-) < c(Cl-) B. 溶液的导电性: a < b
C. 稀释前,c(HX) > 0.01mol/L D. 溶液体积稀释到10倍,HX 溶液的pH < 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.3 molMnO2和100mL 12 mol/L的浓盐酸混合后缓慢加热,充分反应后向剩余的溶液中加入足量的AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑HCl的挥发)( )
A.等于0.6molB.小于0.6mol
C.大于0.6mol,小于1.2molD.等于1.2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com