
【题目】【加试题】在一个容积固定不变的密闭容器中进行反应:
2X(g) + Y(g) ![]() 2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:21m
2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:21m
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H
0;熵变△S 0 ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。

(2)该反应的v-t图像如图2中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图2中右图所示。以下说法正确的是
① a1>a2 ②b1<b2 ③ t1>t2 ④ 右图中阴影部分面积更大 ⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图所示。下列说法正确的是 。

A.A、C两点的反应速率:A>C
B.A、C两点的气体密度:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点X的浓度:A>C
【答案】(1)<,<,低温
(2)②③⑤
(3)B D
【解析】
试题分析:(1)正反应为气体物质的量减小的反应,容器的容积不变,由图可知,状态Ⅱ的压强大于状态Ⅰ压强的2倍,反应在绝热条件下进行,说明正反应为放热反应,则△H<0;正反应后气体的物质的量减少,所以混乱度减小,则△S<0,△H-T△S<0反应自发进行,该反应在低温条件下能自发进行;
(2)加入催化剂,反应速率加快,所以b1<b2,到达平衡的时间缩短,所以t1>t2,平衡不移动,阴影部分为反应物浓度变化量,则两图中阴影部分面积相等;
(3)A. A、C两点都在等温线上,压强A点小于C点,压强越大速率越快,所以反应速率A<C,故A错误;B. A、C两点都在等温线上,反应前后气体物质的量不变,压强越大,容器的容积越小,而混合气体总质量不变,所以气体密度:A<C,故B正确;C. B、C两点X的体积分数相同,则相同组分的体积分数相同,所以气体的平均相对分子质量相同,故C错误;D. 由状态B到状态A,压强相同,温度不同,正反应为放热反应,升高温度化学平衡向吸热反应移动,X的体积分数增大,所以可以通过升温使状态B到状态A,故D正确;E.压强增大,体积减小,依据平衡移动原理,平衡虽然正向移动,但A、C两点X的浓度:C>A,故E错误;故答案为:BD。


科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
已知X和Y均为短周期元素,其原子的第一至第五电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 | I5 |
X | 801 | 2427 | 3660 | 25026 | 32827 |
Y | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
根据上述信息:
①X和氯元素形成的简单分子的空间构型为 。
②Y的基态原子的核外电子排布式为 ,若Y和氯元素形成的分子的相对分子质量为267,请在下列方框中写出该分子的结构式(若存在配位键,用“→”表示)

(2)碳元素可以形成多种单质及化合物:
①C60的结构如图1。C60中的碳原子的杂化轨道类型是 ;


解释:②金刚石中的C-C的键长大于C60中C-C的键长的原因是 ;
③金刚石的熔点高于C60的原因是 ;
(3)如图2是钾的石墨插层化合物的晶胞图(图中大球表示K原子,小球表示C原子),如图3是晶胞沿右侧方向的投影.

①该化合物的化学式是 ;
②K层与C层之间的作用力是 ;
③K层中K原子之间的最近距离是C-C键的键长dC-C的 倍
(4)SiC的晶胞与金刚石的晶胞相似,设碳原子的直径为a cm,硅原子的直径为b cm,则晶胞的边长为 cm(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝和铁是中学化学常见的三种重要金属。请回答下列问题:
(1)钠在空气中燃烧生成淡黄色的 (填“Na2O”或“Na2O2”);
(2)Al2O3能溶于酸或强碱溶液生成盐和水,则是一种 (填“酸性”、“碱性”或“两性”)氧化物;
(3)Fe(OH)3不溶于水,但能溶于酸,请写出Fe(OH)3与盐酸反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) ΔH>0
CO2(g)+3H2(g) ΔH>0
(1)一定条件下,向体积为2 L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),20 s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为________。
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号)________。
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1 mol CH3OH(g)和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为a L。试回答:
①反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH的转化率为________;A、B两容器中H2O(g)的体积百分含量的大小关系为:B________A(填“>”“<”或“=”)。
②若打开K,一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芬顿( Fenton )试例,成分为双氧水和亚铁盐,需要酸性环境。电-Fenton法是用于水体里有机污染物降解的高级氧化技术。其反应原理如图2所示.其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2=Fe3++OH-+·OH,生成的羟基自由基(·OH)对有机物有极强的氧化能力。下列说法正确的是

A.a极是电源的正极
B.电解池中只有O2、Fe3+发生还原反应
C.阳极上发生电极反应:H2O-e-=·OH+H+
D.消耗1molO2,可以产生2mol·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.利用N2和H2合成氨,目前工业的生产条件为:催化剂(铁触媒),温度(400~500℃),压强(30~50MPa),如图为流程示意图:
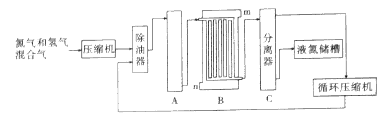
请回答下列问题:
(1)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是__________,__________;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式__________,__________;
(2)设备A中含有电加热器、铁触煤和热交换器,设备A的名称__________,其中发生的化学反应方程式为__________;实际生产中采用400~500℃的高温,原因之一是__________,原因之二是__________。
(3)设备B的名称__________,其中m和n是两个通水口,入水口是__________(填“m”或“n”).不宜从相反方向通水的原因是__________;
(4)设备C的作用__________;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)![]() CO2(g)+H2(g),已知1000K时该反应的平衡常数K=1,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于__________。
CO2(g)+H2(g),已知1000K时该反应的平衡常数K=1,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有_________种。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_________________。
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子杂化轨道类型是_____________,1mol(C2H5O)3P=O分子中含有的σ键的数目为__________________。
(4)已知固态NH3、H2O、HF的氢键键能和结构如下:


解释H2O、HF、NH3沸点依次降低的原因___________________。
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有___________个,与碳原子等距离最近的碳原子有__________个。已知碳化硅晶胞边长为apm,则晶胞图中1号硅原子和2号碳原子之间的距离为________pm,碳化硅的密度为__________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医药中用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,也用作食品添加剂、感光剂等。 工业上用NaOH溶液、水合肼制取碘化钠固体,其制备流程图如下:

已知:N2H4·H2O在100℃以上分解。
(1)已知,在合成过程的反应产物中含有NaIO3,则在合成过程中消耗了3 mol I2,所生成 NaIO3的物质的量为 mol。
(2)写出还原过程中的离子方程式 ;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过 ℃;请选择下列试剂检测所得碘化钠固体中是否含有NaIO3杂质 (选填字母)。
A.FeCl2溶液 B.冰醋酸
C.KI溶液 D.淀粉溶液
(3)测定产品中NaI含量的实验步骤如下:
a.称取4.000g 样品、溶解,在250mL 容量瓶中定容;
b.量取25.00ml 待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用 0.1000mol·L -1 的Na2S2O3,溶液进行滴定至终点(发生反应的方程式为:
2Na2S2O3 +I2===Na2S4O2 +2NaI),重复测定2次,所得的相关数据如下表:
测定 序号 | 待测液体积/ mL | 标准液滴定管起点读数/ mL | 标准液滴定管终点读数/ mL |
1 | 25.00 | 0.06 | 24.04 |
2 | 25.00 | 0.02 | 24.02 |
3 | 25.00 | 0.12 | 24.14 |
①操作b中,加入足量的FeCl3溶液时所发生的离子方程式为 。
②加入A物质为 (填名称);滴定终点观察到的现象为 。
③计算该样品中NaI的含量为 。
(只写出有具体数值的表达式即可)
(4)碘化钠固体的保存方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图有机物分子中带“※”碳原子是手性碳原子(连有四个不同基团的碳原子)。该有机物分别发生下列反应,生成的有机物分子中不会含有手性碳原子的是( )

①与甲酸发生酯化反应
②与足量NaOH水溶液反应
③与银氨溶液作用只发生银镜反应
④催化剂作用下与H2反应
A. ①②③④ B. ①③
C. ②④ D. 以上反应都不成立
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com