
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 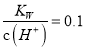 的溶液中:Na+、K+、SiO32—、SO32-
的溶液中:Na+、K+、SiO32—、SO32-
B. pH=1的溶液中:K+、Al3+、SO42-、F—
C. 与镁反应生成氢气的溶液中:Na+、Ba2+、NO3-、Cl-
D. 0.1mol/L的NaHCO3溶液中:NH4+、Mg2+、Br-、AlO2-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】钾、钠及其化合物的性质都类似。回答下列问题:
(1)单质钾与钠相比,熔沸点:K ____(填“>”“<” 或“=”,下同) Na;密度:K____Na。
(2)超氧化钾(KO2)与过氧化钠都能吸收CO2生成碳酸盐和氧气,因此均可用作急救供氧剂。写出超氧化钾与CO2反应的化学方程式:________
(3)若KO2和Na2O2分别与CO2反应时,欲得到等量的氧气,则所需KO2与Na2O2的物质的量之比为________,此时两反应转移的电子数之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化还原反应,下列说法正确的是( )
A. 被氧化的物质是还原剂
B. 氧化剂被氧化,还原剂被还原
C. 失去电子,化合价降低的物质是还原剂
D. 氧化剂失去电子,化合价升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质的判断中,正确的观点是( )
A. 在熔融状态下能导电的物质
B. 在水溶液或熔融状态下能导电的物质
C. 在水溶液或熔融状态下能导电的化合物
D. 在水溶液和熔融状态下都能导电的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为pg .cm-3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的有
①![]() ②
②![]() ③上述溶液中加入VmL水后,所得溶液的质量分数大于0.5ω ④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
③上述溶液中加入VmL水后,所得溶液的质量分数大于0.5ω ④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A. ②③ B. ②④ C. ③④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种物质,已知它们在相同条件下能发生下列三个化学反应:
①A2++B===B2++A ②B2++C===C2++B ③C2++D===D2++C
推断A、B、C、D的还原性由强到弱的顺序是( )
A. A>B>C>D B. C>A>B>D
C. B>D>A>C D. D>C>B>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.8mol X 气体和0.4mol Y 气体混合于2L 密闭容器中,使它们发生如下反应:2X(g)+Y (g)n Z (g)+2W (g).2min 末已生成0.2mol W,若测知以Z的浓度变化表示的反应速率为0.05mol(Lmin)﹣1 , 计算:
(1)前2min内用X的浓度变化表示的平均反应速率;
(2)2min末时Y的浓度.
(3)化学反应方程式中n 值是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外电子数之和为21.下列关系正确的是( )
W | X | |||
Y | Z |
A. 氢化物沸点:W<Z
B. 氧化物对应水化物的酸性:Y>W
C. Y2X3与YZ3化合物类型相同
D. 简单离子的半径:Y<X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com