
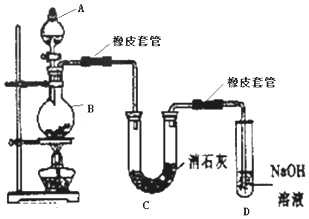
分析 (1)浓盐酸与二氧化锰在加热条件下生成氯化锰和氯气;浓盐酸易挥发,制得的氯气中混有氯化氢气体和水蒸气;
(2)漂白粉的有效成分为次氯酸钙;氯气有毒,用氢氧化钠吸收,生成氯化钠和次氯酸钠;
(3)因为温度高时易生成Ca(ClO3)2,所以避免此反应发生可以采取降温措施,盐酸易挥发,氯化氢与氢氧化钙反应;
(4)由题目信息可知,Cl2将溶液中的I2氧化成HIO3,自身被还原为HCl,配平书写方程式;氧化剂和还原剂反应生成氧化产物和还原产物,氧化剂氧化性大于氧化产物的氧化性,以此分析.
解答 解:(1)A、B中的反应物分别是浓盐酸和MnO2.发生的化学方程式为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;浓盐酸易挥发,制得的氯气中混有氯化氢气体和水蒸气;
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;HCl;H2O;
(2)漂白粉的有效成分为次氯酸钙Ca(ClO)2;D中为氢氧化钠,吸收氯气,发生的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Ca(ClO)2;Cl2+2OH-=Cl-+ClO-+H2O;
(3)①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免副反应发生,应该降低温度,所以可以采取将U型管置于冷水浴中的措施;
故答案为:将U型管置于冷水浴中;
②盐酸易挥发,加热过程中生成的氯气中含有氯化氢,氯化氢能和碱反应,所以反应方程式为:Ca(OH)2+2HCl=CaCl2+2H2O,为避免副反应发生,可以在B、C之间连接一个盛有饱和食盐水的洗气瓶;
故答案为:在B、C之间连接一个盛有饱和食盐水的洗气瓶;
(4)由题目信息可知,Cl2将溶液中的I2氧化成HIO3,自身被还原为HCl,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl,碘被氧化生成生成HIO3,说明氧化性Cl2>HIO3,KI溶液换成KBr溶液,滴加氯水,溶液呈橙黄色;滴加氯水至过量,颜色没有变化,可说明氯气不未检测到HBrO3的存在,能将溴进一步氧化,说明氧化性HBrO3>Cl2,则有HBrO3>Cl2>HIO3;
故答案为:6H2O;2HIO3+10HCl;橙黄;HBrO3>Cl2>HIO3.
点评 本题考查了物质的制备,涉及了氯气的实验室制法、气体除杂、尾气的处理、氧化性强弱比较及应用等知识点,为高考频点,注意对基础知识的掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷中混有乙烯,将其通入酸性高锰酸钾溶液中洗气 | |
| B. | 乙烯中混有二氧化硫,将其通入氢氧化钠溶液中洗气 | |
| C. | 乙炔中混有硫化氢,将其通入溴水中洗气 | |
| D. | 溴苯中混有溴,加入汽油,振荡,用汽油萃取出溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能使酸性KMnO4溶液、溴水、品红溶液褪色,且原理相同 | |
| B. | 不能用澄清石灰水鉴别SO2和CO2 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| D. | 少量SO2通过浓的CaCl2溶液能生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数 | B. | 中子数 | C. | 质子数 | D. | 电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200 mL 1 mol•L-1 KCl溶液 | B. | 50 mL 2 mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 NaCl溶液 | D. | 50 mL 1 mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
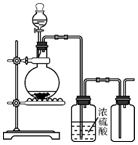
| A. | 铜和稀硝酸制一氧化氮 | B. | 亚硫酸钠与硫酸制二氧化硫 | ||
| C. | 锌和稀硫酸制氢气 | D. | 硫化亚铁与稀硫酸制硫化氢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com