
【题目】部分弱电解质的电离常数如下表:
弱电解质 | HCOOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列说法错误的是( )
A. 结合H+的能力:CO32->CN->HCO3->HCOO-
B. 2CN-+H2O+CO2=2HCN+CO32-
C. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D. 25 ℃时,反应HCOOH + CN-![]() HCN+ HCOO-的化学平衡常数3.67×105
HCN+ HCOO-的化学平衡常数3.67×105
【答案】B
【解析】
A.由HCOOH 、HCN 的电离常数Ka=1.8×10-4、Ka=4.9×10-10,H2CO3的电离常数Ka1=4.3×10-7 、Ka2=5.6×10-11, 结合H+的能力:CO32->CN->HCO3->HCOO-,故A正确;B.根据电离平衡常数有CN-+H2O+CO2=HCN+HCO3-,故B错误;C.因为HCOOH比HCN酸性强,中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故C正确;D. 25 ℃时,反应HCOOH + CN-![]() HCN+ HCOO-的化学平衡常数K=c HCOO-)
HCN+ HCOO-的化学平衡常数K=c HCOO-)![]() c(HCN)/cHCOOH )
c(HCN)/cHCOOH )![]() c(CN-)= Ka(HCOOH)/ Ka((HCN)= 1.8×10-4/4.9×10-10 =3.67×105,故D正确。答案:B。
c(CN-)= Ka(HCOOH)/ Ka((HCN)= 1.8×10-4/4.9×10-10 =3.67×105,故D正确。答案:B。


科目:高中化学 来源: 题型:
【题目】工业上常采用吸收-电解联合法除去天然气中的H2S气体,并转化为可回收利用的单质硫,其装置如下图所示。通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率即可保证装置中反应的连续性。下列说法正确的是

A. 与电源a端相连的碳棒为阳极,气体A为O2
B. 与电源b端相连的碳棒上电极反应为:2H2O+2e-=2OH-+H2↑
C. 通电过程中,右池溶液中的OH-通过阴离子膜进入左池
D. 在通电前后,右池中的c(NaOH)与c(Na2S)之比基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是
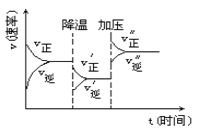
A. 正反应是放热反应
B. A、B一定都是气体
C. D一定不是气体
D. C可能是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关水电离情况的说法正确的是
A. 25℃,pH=12 的烧碱溶液与纯碱溶液,水的电离程度相同
B. 其它条件不变,CH3COOH溶液在加水稀释过程中,c(OH-)/c(H+)一定变小
C. 其它条件不变,稀释氢氧化钠溶液,水的电离程度减小
D. 其它条件不变,温度升高,水的电离程度增大,Kw 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】严重的雾霾天气的形成与汽车尾气排放有关。汽车尾气中常含有CO、NOx等气体,为减轻污染,一般汽车都加装了“催化净化器”,可将汽车尾气中的有毒气体转化为无污染的气体。某化学兴趣小组在实验室模拟汽车尾气处理,设计了下图所示装置(部分夹持装置已略去)。
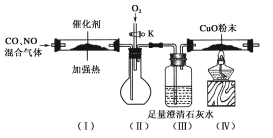
(1)装置(Ⅲ)的主要作用为________________________。
(2)停止加热,打开活塞K,放入适量氧气时,装置(Ⅱ)中可观察到的现象是___________________。
(3)该套装置中有不完善之处,还应在装置(Ⅳ)后补充____________。
(4)工业上常用纯碱液来吸收NOx,有关反应的化学方程式为2NO2+Na2CO3===NaNO2+NaNO3+CO2、NO2+NO+Na2CO3===2NaNO2+CO2。现有标准状况下a L NO2和b L NO的混合气体恰好被200 mL Na2CO3溶液完全吸收,则a、b应满足的关系为________。Na2CO3溶液的物质的量浓度为________mol·L-1(不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丁炔二醇可以制备1,3-丁二烯。请根据下面的合成路线图填空:
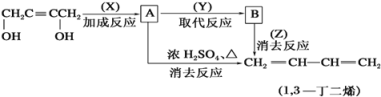
(1)写出各反应的反应条件及试剂:X____________;Y____________;Z_____________。
(2)写出A、B的结构简式:A____________________;B____________________。
(3)写出生成1,3-丁二烯的化学方程式:
①由A生成:_______________________________________________________。
②由B生成:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】隔绝空气加热至500℃时硫酸亚铁铵[(NH4)2Fe(SO4)2]能完全分解,分解产物中含有铁 氧化物、硫氧化物、氨气和水蒸气等。
[实验探究]某化学小组选用下图所示部分装置进行分步实验(夹持装置略)。
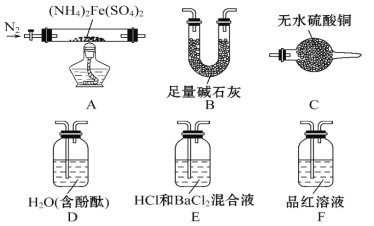
实验Ⅰ 甲同学为探究分解产物中的硫氧化物是 SO2 还是 SO3,连接装置A-E-F-B 进行实验。
(1)实验过程中观察到:E 中没有明显现象,F 中溶液褪色,据此得出的结论是 。
(2)B 的作用是_____。
实验Ⅱ 验证分解产物中含有水蒸气和氨气,并探究残留固体成分。
(3)所选用装置的正确连接顺序为_____(填装置的字母序号)。
(4)证明有水蒸气生成的实验现象为_____。
(5)证明有氨气生成的实验现象为_____。
(6)A 中固体完全分解后变为红棕色粉末,设计实验证明A 中残留固体中含有三价铁_______________。
(7)实验证明(NH4)2Fe(SO4)2 受热分解除上述产物外,还有N2 生成,写出A 中反应的化学方程式__________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com