
某原电池装置如下图所示。下列有关叙述中,正确的是
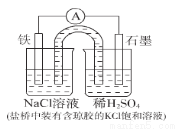
A.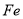 作正极,发生氧化反应 B. 工作一段时间后,两烧杯中溶解
作正极,发生氧化反应 B. 工作一段时间后,两烧杯中溶解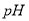 均不变
均不变
C.负极反应: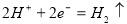 D. 工作一段时间后,NaCl溶液中c(Cl-)增大
D. 工作一段时间后,NaCl溶液中c(Cl-)增大
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:计算题
(本题共14分)
硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。
完成下列计算:
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为________mol/。
(2)若以浓硫酸吸水后生成的H2SO4·H2O计算,250g质量分数为98%的硫酸能吸收多少g水?
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2 4FeS2+11 O2→2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比。
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。
硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体)。(已知空气组成:N2体积分数0.79、O2体积分数0.21)
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省原名校高三高考仿真模拟统一考试理综化学试卷(解析版) 题型:填空题
[化学一选修3:物质结构与性质](15分)
(1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29。回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为_________,1molY2X2含有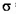 键的数目为____ __________________.
键的数目为____ __________________.
②化合物ZX3的沸点比化台物YX4的高,其主要原因是_____________。
③元素Y的一种氧化物与元素z的一种氧化物互为等电子体,元素z的这种氧化物的分子式是_____________。
(2)铁元素能形成多种配合物,如:Fe(CO)x
①基态Fe3+的M层电子排布式为___________________________。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18.则x=_________。常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于
(填晶体类型):
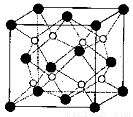
(3)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为_________。已知该晶胞的密度为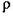 g/cm
g/cm ,阿伏加德罗常数为
,阿伏加德罗常数为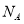 ,求晶胞边长a=________cm。(用含
,求晶胞边长a=________cm。(用含 的计算式表示)
的计算式表示)
(4)下列有关的说法正确的是_____________。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能Ca0比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:填空题
(6分)水溶液中存在水的电离平衡。
(1)常温时,在稀溶液中c(H+)和c(OH-)的乘积总是等于 。
(2)用“>”、“<”或“=”填空: 碱性溶液中,c(H+) c(OH-),在常温时pH 7。
(3)有下列几种溶液:A. NH3·H2O B. CH3COONa C. NH4Cl D. NaHSO4
常温下呈酸性的溶液有 (填序号)
用离子方程式或电离方程式表示这些溶液呈酸性的原因:___________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
在室温下,下列叙述正确的是
A.将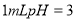 的一元酸溶液稀释到
的一元酸溶液稀释到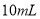 ,若溶液的
,若溶液的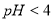 ,则此酸为弱酸
,则此酸为弱酸
B.将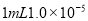
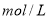 盐酸稀释到
盐酸稀释到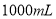 ,得到
,得到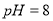 的盐酸
的盐酸
C. 用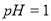 的盐酸分别中和
的盐酸分别中和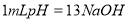 溶液和氨水,
溶液和氨水,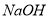 消耗盐酸的体积大
消耗盐酸的体积大
D. 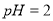 的盐酸与
的盐酸与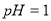 的硫酸比较,
的硫酸比较,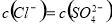
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
已知在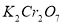 的溶液中存在着如下平衡:
的溶液中存在着如下平衡:
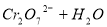

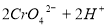 加入下列物质能使溶液变为橙色的是
加入下列物质能使溶液变为橙色的是
(橙色) (黄色)
A. 氨水B. 硫酸 C. 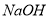 D. 水
D. 水
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
工业上,通常用电解法冶炼的金属是
A. Al B. Fe C. Cu D. Ag
查看答案和解析>>
科目:高中化学 来源:2014~2015学年重庆市9月月考高一化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列叙述中不正确的是:
A.常温常压下,1mol甲基(-CH3)含有的电子数为9NA
B.1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后胶体粒子的数目小于NA
C.标况下,2.24LHF中含有的电子数为NA
D.1 mol 金刚砂(SiC)中含有4NA碳硅键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com