
【题目】为探究黑色固体X(仅含两种元素)的组成和性质,设计并完成如下实验: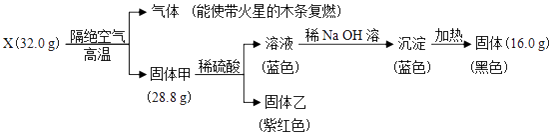
请回答:
(1)X的化学式是 .
(2)固体甲与稀硫酸反应的离子方程式是 .
(3)加热条件下氨气被固体X氧化成一种气体单质,写出该反应的化学方程式 .
【答案】
(1)CuO
(2)Cu2O+2H+=Cu++Cu+H2O
(3)3CuO+2NH3 ![]() 3Cu+N2+3H2O
3Cu+N2+3H2O
【解析】解:流程中32gX隔绝空气加热分解放出了能使带火星的木条复燃的气体为氧气,质量=32.0g﹣28.8g=3.28g,证明X中含氧元素,28.8g固体甲和稀硫酸溶液反应生成蓝色溶液,说明含铜离子,证明固体甲中含铜元素,即X中含铜元素,铜元素和氧元素形成的黑色固体为CuO,X为氧化铜,n(CuO)= ![]() =0.4mol,结合质量守恒得到n(O2)=
=0.4mol,结合质量守恒得到n(O2)= ![]() =0.1mol,氧元素守恒得到甲中n(Cu):n(O)=0.2mol:(0.4mol﹣0.1mol×2)=2:1,固体甲化学式为Cu2O,固体乙为Cu,蓝色溶液为硫酸铜,加入氢氧化钠溶液生成氢氧化铜沉淀,加热分解得到16.0g氧化铜,(1)分析可知X为CuO,所以答案是:CuO;(2)固体甲为Cu2O,氧化亚铜和稀硫酸溶液反应发生气化反应生成铜、亚铜离子,反应的离子方程式为:Cu2O+2H+=Cu++Cu+H2O,
=0.1mol,氧元素守恒得到甲中n(Cu):n(O)=0.2mol:(0.4mol﹣0.1mol×2)=2:1,固体甲化学式为Cu2O,固体乙为Cu,蓝色溶液为硫酸铜,加入氢氧化钠溶液生成氢氧化铜沉淀,加热分解得到16.0g氧化铜,(1)分析可知X为CuO,所以答案是:CuO;(2)固体甲为Cu2O,氧化亚铜和稀硫酸溶液反应发生气化反应生成铜、亚铜离子,反应的离子方程式为:Cu2O+2H+=Cu++Cu+H2O,
所以答案是:Cu2O+2H+=Cu++Cu+H2O;(3)加热条件下氨气被固体X位氧化铜氧化成一种气体单质为氮气,反应的化学方程式为:3CuO+2NH3 ![]() 3Cu+N2+3H2O,
3Cu+N2+3H2O,
所以答案是:3CuO+2NH3 ![]() 3Cu+N2+3H2O.
3Cu+N2+3H2O.


科目:高中化学 来源: 题型:
【题目】一种充电电池放电时的电极反应为:H2+2OH﹣﹣2e﹣=2H2O;NiO(OH)+H2O+e﹣=Ni(OH)2+OH﹣当为电池充电时,与外电源正极连接的电极上发生的反应是( )
A.H2O的还原
B.NiO(OH)的还原
C.H2的氧化
D.Ni(OH)2的氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中 Cl- 、Br- 、I - 三者物质的量之比为1∶2∶3,通入一定量的氯气,当反应后,该比值为3∶2∶1,则反应的氯气和原溶液中I-的物质的量之比为
A.3∶2B.2∶3C.1∶2D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的电子式为____________________;
(2)写出B中官能团的名称:____________;D中官能团的名称:____________。
(3)写出下列反应的化学方程式并注明反应类型:
①___________________________;反应类型_____________;
②___________________________;反应类型_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( ) 
A.30min时降低温度,40min时充入生成物C
B.0~8min内A的平均反应速率为0.08mol/(Lmin)
C.反应方程式中的x=1,正反应为吸热反应
D.20min~40min间该反应的平衡常数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素其原子半径随原子序数的变化如下图。
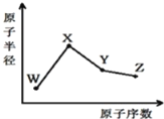
已知W一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期中最强。下列说法正确的是 ( )
A. 对应的气态氢化物的稳定性:Y>Z
B. X的非金属性是同周期中最强的
C. 对应简单离子的半径:X>W
D. Y的氧化物能与X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5 . 回答下列问题.
(1)已知AX3的熔点和沸点分别为﹣93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成lmol AX5 , 放出热量123.8kJ.该反应的热化学方程式为 .
(2)反应AX3(g)+X2(g)AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.
①下列不能说明反应达到平衡状态的是 .
A.混合气体的平均相对分子质量保持不变
B.混合气体密度保持不变
C.体系中X2的体积分数保持不变
D.每消耗1molAX3同时消耗1molAX5
②计算实验a从反应开始至达到平衡时的反应速率v(AX5)=(保留2位有效数字).
③图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为(填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b、c . 该反应在实验a和实验c中的化学平衡常数的大小关系是KaKc(填“>、<或=”),其中Kc=(保留小数点后1位).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有着重要的应用.请按要求写出相应的方程式.
(1)将含SO2的废气通入含Fe2+(催化剂)的溶液中,常温下可使SO2转化为SO24﹣ , 其总反应为2SO2+O2+2H2O=2H2SO4 . 上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: .
(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6﹣2x]溶液.若溶液的pH偏高,则碱式硫酸铝产率降低且有气泡产生,用化学方程式表示其原因: .
(3)ClO2是一种高效安全的杀菌消毒剂.氯化钠电解法生产ClO2工艺原理示意图如下: 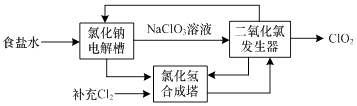
①写出氯化钠电解槽内发生反应的离子方程式: .
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目: .
③ClO2能将电镀废水中的CN﹣离子氧化成两种无毒气体,自身被还原成Cl﹣ . 写出该反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】简单原子的原子结构可用下图来形象表示:
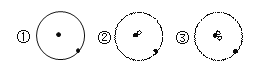
其中·表示质子或电子,°表示中子,则下列有关的叙述中,不正确的是( )
A. ①②③具有相同的质子数
B. ①②③互为同位素
C. ①②③是三种粒子的化学性质几乎完全相同
D. ①②③具有的电子数不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com