
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
分析 实验一:(1)探究温度对速率的影响时,其他条件要保持不变,使温度成为唯一变量,实验①、实验②和实验③的温度相同,浓度不同,反应物的浓度为变量;
(2)利用三段法结合v=$\frac{△C}{△t}$计算氢气的反应速率;
实验二:(3)影响反应速率的因素除了浓度、温度外,催化剂也影响反应速率;
(4)根据反应方程式可知,反应产物中锰离子随着反应的进行,浓度变化较大,反应前加入硫酸锰,根据反应速率大小判断锰离子是否在该反应中起到催化作用.
解答 解:实验一:(1)其他条件不变探究温度对化学反应速率的影响时,要让浓度保持一致,温度成为唯一变量,①⑤和②④这两组浓度一致,因此可选①⑤或②④,实验①、实验②和实验③的温度相同,浓度不同,因此探究的是浓度对化学反应速率的影响,
故答案为:①⑤或②④;比较改变不同反应物的浓度对反应速率的影响;
(2)由4amolH2和2amolN2放入VL的密闭容器中,充分反应后测得N2的转化率为50%,则
N2 +3H2 ?2NH3
开始mol/L 2×$\frac{a}{v}$ 4×$\frac{a}{v}$ 0
转化mol/L $\frac{a}{v}$ 3×$\frac{a}{v}$ 2×$\frac{a}{v}$
平衡mol/L $\frac{a}{v}$ $\frac{a}{v}$ 2×$\frac{a}{v}$
用H2表示的反应速率为$\frac{3a}{\frac{v}{5min}}$=$\frac{3a}{5V}$ mol/(L•min)
故答案为:$\frac{3a}{5V}$ mol/(L•min);
实验二:(3)对化学反应速率影响最快的是催化剂,故猜想还可能是催化剂的影响,
故答案为:催化剂(或硫酸锰或Mn2+的催化作用);
(4)反应方程式2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑中,浓度变化较大的为锰离子,所以选择的可以做催化剂的试剂应该含有锰离子的硫酸盐,故只有B正确,
故答案为:B.
点评 本题考查外界条件对化学反应速率的影响,探究单一条件对速率的影响时,要让此条件成为唯一变量,题目难度不大.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 物质的量浓度相等的①NH4Cl②(NH4)2SO4③NH4Al(SO4)2三种溶液中,c(NH4+)由大到小的顺序为:③>②>① | |
| B. | 0.1mol•L-1CH3COOH与0.05mol•L-1NaOH溶液等体积混合(pH<7): c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| C. | 0.1mol•L-1Na2CO3与0.05mol•L-1NaHCO3溶液等体积混合: $\frac{3}{5}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 在0.1mol•L-1NaHC2O4溶液(pH<7)中:c(OH-)+2c(C2O42-)=c(H+)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氨水具有挥发性 | |
| B. | 1mol/L氨水溶液的pH=10 | |
| C. | 1mol/LNH4Cl溶液的pH=5 | |
| D. | 氨水与AlCl3溶液反应生成Al(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
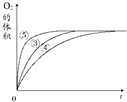 分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
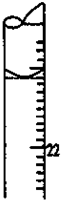 某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 金属质量(g) | 金属状态 | C(H2SO4)(mol/L) | V(H2SO4)(mL) | 溶液温度(℃) | 金属消失的时间(s) | |
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 数据模糊 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 数据模糊 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 数据模糊 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 数据模糊 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 数据丢失 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
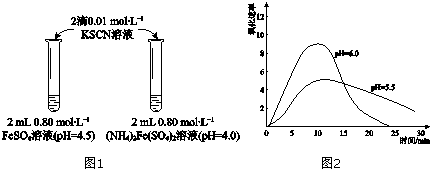
| 物质 | 0min | 1min | 1h | 5h |
| FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
| (NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
| 操作 | 现象 |
| 取取2mLpH=4.0的0.80mol•L-1FeSO4溶液,加加2滴0.01mol•L-1KSCN溶液,观察. | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com