
| A. | c(NH4+)相等的NH4Cl溶液中的c(Cl-)大于(NH4)2Fe(SO4)2溶液中c(SO42-) | |
| B. | 常温下,pH=1的醋酸与pH=13的NaOH 溶液混合后的溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1mol•L-1的Na2CO3和NaHCO3混合溶液中 2c(Na+)═3c(CO32-)+3c(HCO3-) | |
| D. | 稀释氯化铵溶液过程中,NH4+的水解程度和水的电离程度都增大 |
分析 A.(NH4)2Fe(SO4)2溶液中,亚铁离子水解抑制了铵根离子的水解,则铵根离子浓度相同时氯化铵的浓度大于(NH4)2Fe(SO4)2溶液浓度的2倍;
B.醋酸为弱电解质,混合液中醋酸过量,溶液呈酸性,则c(H+)>c(OH-);
C.根据度均为0.1mol•L-1的Na2CO3和NaHCO3混合溶液中的物料守恒判断;
D.NH4Cl溶液,加水稀释,其浓度减小,对水的电离的促进程度减小.
解答 解:A.(NH4)2Fe(SO4)2溶液中,亚铁离子水解抑制了铵根离子的水解,则c(NH4+)相等时NH4Cl的浓度大于(NH4)2Fe(SO4)2溶液浓度的2倍,氯离子和硫酸根离子不水解,则NH4Cl溶液中的c(Cl-)大于(NH4)2Fe(SO4)2溶液中c(SO42-),故A正确;
B.常温下,pH=1的醋酸与pH=13的NaOH 溶液混合后的溶液中,醋酸为弱酸,则混合液中醋酸过量,混合液呈酸性:c(H+)>c(OH-),根据电荷守恒可知:(CH3COO-)>c(Na+),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.浓度均为0.1mol•L-1的Na2CO3和NaHCO3混合溶液中,根据物料守恒可得:2c(Na+)═3c(CO32-)+3c(H2CO3)+3c(HCO3-),故C错误;
D.NH4Cl溶液,加水稀释,铵根离子的水解程度增大,但铵根离子的浓度减小,对水的电离的促进程度减小,所以水的电离程度会减小,故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答结构,注意掌握电荷守恒、物料守恒的含义及应用方法,D为易错点,注意铵根离子浓度减小后,水的电离程度减小,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
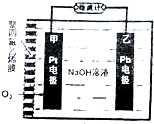 氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变,一段时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg.下列说法正确的是( )
氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变,一段时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg.下列说法正确的是( )| A. | Pt电极上发生氧化反应 | |
| B. | Pt上发生的电极反应式为4OH--4e-═O2↑+2H2O | |
| C. | 反应过程中转移OH-的物质的量为0.25bmol | |
| D. | 待测气体中氧气的体积分数为0.7$\frac{b}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇不能发生取代反应 | B. | C4H10(丁烷)有三种同分异构体 | ||
| C. | 氨基酸、淀粉均属于高分子化合物 | D. | 油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
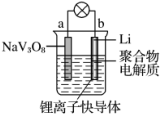 水系锂电池具有安全、环保和价格低廉等优点,成为当前电池研究领域的热点. 以钒酸钠(NaV3O8)为正极材料的电极反应式为NaV3O8+xLi++xe-═NaLixV3O8,则下列说法不正确的是( )
水系锂电池具有安全、环保和价格低廉等优点,成为当前电池研究领域的热点. 以钒酸钠(NaV3O8)为正极材料的电极反应式为NaV3O8+xLi++xe-═NaLixV3O8,则下列说法不正确的是( )| A. | 放电时,负极的电极反应式:Li-e-═Li+ | |
| B. | 该电池可以用硫酸钠溶液作电解质 | |
| C. | 充电过程中阳极的电极反应式:NaLixV3O8-xe-═NaV3O8+xLi+,NaLixV3O8中钒的化合价发生变化 | |
| D. | 充电过程中Li+从阳极向阴极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沸点/℃ | 水溶性 | |
| 甲醇 | 65 | 与水混溶 |
| 甲醛 | -21 | 与水混溶 |
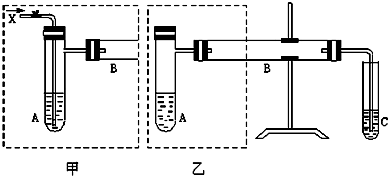
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
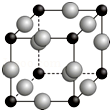 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com