
【题目】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857 ℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:

①Fe(CrO2)2中各元素化合价均为整数,则铬为_______价。
②高温氧化时反应的化学方程式为_____________________。
③操作a由两种均发生了化学反应的过程构成的,其内容分别是__________、铝热反应。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式______________、___________________________。
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。
①处理含有Cr2O72-的污水方法通常为:用铁作电极电解污水,Cr2O72-被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为______________,若要处理含10 mol Cr2O72-的污水,则至少需要消耗的铁为_______g。
②转化为重要产品磁性铁铬氧体 (CrxFeyOz):先向含CrO42-的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出CrO42-在酸性条件下被Fe2+还原为Cr3+ 的离子方程式:_____,若处理含1 mol CrO42-(不考虑其它含铬微粒)的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为__________。
【答案】+34Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+8CO2灼烧使 Cr(OH)3分解NaCrO2Cr2(SO4)32H2O+2e=2OH+H2 ↑(或者2H++2e=H2↑)33603Fe2++ CrO42-+8H+=3Fe3++Cr3++4H2OCr2Fe20O27
2Fe2O3+8Na2CrO4+8CO2灼烧使 Cr(OH)3分解NaCrO2Cr2(SO4)32H2O+2e=2OH+H2 ↑(或者2H++2e=H2↑)33603Fe2++ CrO42-+8H+=3Fe3++Cr3++4H2OCr2Fe20O27
【解析】
(1)①根据化合物中各元素的正负化合价代数和为0分析。
②根据流程确定反应物和生成物,用化合价升降法配平书写化学方程式。
③由流程Cr(OH)3→Cr和铝热反应逆推。
(2)模仿Al(OH)3与NaOH、稀硫酸的反应确定生成物。
(3)①在阴极H+放电,根据电子守恒和原子守恒计算。
②根据化合价升降法配平书写离子方程式,根据原子守恒和电荷守恒确定化学式。
(1)①Fe(CrO2)2中Fe、Cr的化合价分别为+x、+y,根据化合物中各元素的正负化合价代数和为0,(+x)+2×(+y)+4×(-2)=0,x、y均为整数,经讨论x=2,y=3,Fe的化合价为+2价,Cr的化合价为+3价。
②根据流程,高温氧化时Fe(CrO2)2与Na2CO3、O2反应生成CO2、Fe2O3、Na2CrO4,反应可写成Fe(CrO2)2+Na2CO3+O2→CO2+Fe2O3+Na2CrO4,在反应中Fe元素的化合价由+2价升至+3价、Cr元素的化合价由+3价升至+6价,1molFe(CrO2)2参与反应失去7mol电子,1molO2参与反应得到4mol电子,根据电子守恒和原子守恒配平,高温氧化时反应的化学方程式为:4Fe(CrO2)2+8Na2CO3+7O2![]() 8CO2+2Fe2O3+8Na2CrO4。
8CO2+2Fe2O3+8Na2CrO4。
③操作a将Cr(OH)3经两步反应生成Cr,后一步为铝热反应,则第一步反应为灼烧使Cr(OH)3分解,两步反应的化学方程式为2Cr(OH)3![]() Cr2O3+3H2O、2Al+Cr2O3
Cr2O3+3H2O、2Al+Cr2O3![]() Al2O3+2Cr。
Al2O3+2Cr。
(2)Cr(OH)3与Al(OH)3都属于两性氢氧化物,模仿Al(OH)3与NaOH、稀硫酸的反应,Cr(OH)3与NaOH、稀硫酸反应的化学方程式分别为Cr(OH)3+NaOH=NaCrO2+2H2O、2Cr(OH)3+3H2SO4=Cr2(SO4)3+6H2O,Cr(OH)3与NaOH、稀硫酸反应生成的盐的化学式为NaCrO2、Cr2(SO4)3。
(3)①以Fe作电极,阳极电极反应式为Fe-2e-=Fe2+,阴极电极反应式为2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑)。在阳极区Fe2+将Cr2O72-还原为Cr3+,Fe2+自身被氧化成Fe3+,1molCr2O72-得到6mol电子生成2molCr3+,1molFe2+失去1mol电子生成1molFe3+,根据得失电子守恒,n(Fe2+)=6n(Cr2O72-)=6×10mol=60mol,根据Fe守恒,至少需要消耗Fe的物质的量为60mol,至少需要消耗Fe的质量为60mol×56g/mol=3360g。
②酸性条件下CrO42-被Fe2+还原为Cr3+,Fe2+被氧化成Fe3+,反应可写成Fe2++CrO42-+H+→Fe3++Cr3++H2O,在反应中1molFe2+失去1mol电子,1molCrO42-得到3mol电子,根据得失电子守恒、原子守恒和电荷守恒,CrO42-在酸性条件下被Fe2+还原为Cr3+的离子方程式为3Fe2++CrO42-+8H+=3Fe3++Cr3++4H2O。根据Fe守恒,铁铬氧体中n(Fe2+)=10mol×![]() =6mol,n(Fe3+)=10mol×
=6mol,n(Fe3+)=10mol×![]() =4mol,根据Cr守恒,铁铬氧体中n(Cr3+)=n(CrO42-)=1mol,根据电荷守恒,铁铬氧体中n(O2-)=
=4mol,根据Cr守恒,铁铬氧体中n(Cr3+)=n(CrO42-)=1mol,根据电荷守恒,铁铬氧体中n(O2-)=![]() =13.5mol,铁铬氧体中n(Cr):n(Fe):n(O)=1mol:10mol:13.5mol=2:20:27,铁铬氧体的化学式为Cr2Fe20O7。
=13.5mol,铁铬氧体中n(Cr):n(Fe):n(O)=1mol:10mol:13.5mol=2:20:27,铁铬氧体的化学式为Cr2Fe20O7。


科目:高中化学 来源: 题型:
【题目】〔化学—选修3:物质结构与性质〕(15分)
早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: 可用硫氰化钾奉验三价铁离子,形成配合物的颜色为
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为 ;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W、X、Y、Z的分子式均为C7H8,Z的空间结构类似于篮子。下列说法正确的是
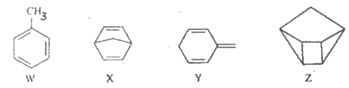
A. Z的一氯代物只有3种
B. 化合物W的同分异构体只有X、Y、Z
C. X、Y、Z均可与酸性KMnO4溶液反应
D. 1molX、1molY与足量Br2/CCl4溶液反应最多消耗Br2均为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3个,下列说法正确的是( )

A. 氧化物对应水化物酸性W比Z强
B. Y单质与Z的氢化物水溶液反应,有沉淀生成
C. X单质在室温下为固体
D. 简单离子的半径:Z<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年8月3日,中国科学家在《Nature》杂志发表论文,合成了一种代号为ICM-101的高能量密度材料。合成该高能物质的主要原料为草酰二肼,结构简式如图所示。下列有关草酰二肼的说法正确的是
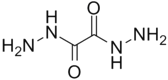
A. 可由草酸(HOOC-COOH)和肼(H2N-NH2)发生酯化反应制备
B. 不能发生水解反应
C. 与联二脲(H2NCONHNHCONH2)互为同分异构体
D. 分子中最多有12个原子处于同一平面(已知NH3分子构型为三角锥)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能达到目的的实验方案是
A.用浓硫酸干燥氨气
B.用乙醇萃取溴水中的溴单质
C.用淀粉溶液鉴别溴水和碘水
D.用酚酞溶液鉴别氢氧化钠溶液和氢氧化钾溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com