
分析 (1)增大压强,有利于增大气体在丁醇中的溶解度,加快化学反应速率;根据V(H2O)=$\frac{△c}{△t}$计算;
(2)根据到达平衡时各组分的百分含量不变,正反应速率等于逆反应速率判断;升高温度、增大压强、使用催化剂等能加快化学反应速率,但不一定影响平衡移动;
(3)根据条件知,反应方程式为:NaClO+H2C2O4→NaCl+H2O+2CO2↑;
(4)已知草酸氢钠溶液显酸性,故电离大于水解,
a.通入HCl气体,会与草酸氢根离子反应生成二氧化碳;
b.加入草酸晶体,使草酸根离子浓度增大;
c.通入NH3,促进电离;
d.加入草酸钾晶体,使草酸根离子浓度增大,抑制了草酸氢根离子的电离;
(5)根据反应方程式可知,酸性强弱顺序为:H2C2O4>H2SO3>HC2O4->HSO3-,酸性越强,K越大.
解答 解:(1)根据反应①4CO+4C4H9OH+O2 $→_{13~15MPa}^{PdCl_{2}•CuCl_{2}}$2(COOC4H9)2+2H2O知,增大压强,有利于增大气体在丁醇中的溶解度,加快化学反应速率;若5min内水的质量增加了7.2g/L,则浓度增加0.4mol/L,则用水表示的反应速率为V(H2O)=$\frac{0.4mol/L}{5min}$=0.08mol/(L•min);
(2)反应(COOC4H9)2+2H2O?H2C2O4+2C4H9OH-Q(Q>0)中,
a.温度不变,平衡常数不变,但不一定平衡,故错误;
b.反应液的pH保持不变,一定平衡,故正确;
c.浓度为变量,丁醇的浓度保持不变,则一定平衡,故正确;
d.反应液的总质量保持不变,不一定平衡,故错误;
故选bc;
下列措施中,a.合理升高反应温度,反应速率加快,平衡正向移动,故正确;
b.增大反应压强,速率几乎无影响,平衡不移动,故错误;
c.增大水的用量,水为纯液体,无影响,故错误;
d.加入稀硫酸作为催化剂,化学反应速率加快,但平衡不移动,故错误;
故选a;
故答案为:bc;a;
(3)根据条件知,反应方程式为:NaClO+H2C2O4→NaCl+H2O+2CO2↑,故答案为:NaClO+H2C2O4→NaCl+H2O+2CO2↑;
(4)已知草酸氢钠溶液显酸性,故电离大于水解,下列措施能使草酸氢钠溶液中$\frac{c(N{a}^{+})}{c(H{C}_{2}{O}_{4}^{-})}$减小的是 bd.
a.通入HCl气体,会与草酸氢根离子反应生成二氧化碳,$\frac{c(N{a}^{+})}{c(H{C}_{2}{O}_{4}^{-})}$增大,故错误;
b.加入草酸晶体,使草酸根离子浓度增大,故$\frac{c(N{a}^{+})}{c(H{C}_{2}{O}_{4}^{-})}$减小,故正确;
c.通入NH3,促进电离,$\frac{c(N{a}^{+})}{c(H{C}_{2}{O}_{4}^{-})}$增大,故错误;
d.加入草酸钾晶体,使草酸根离子浓度增大,抑制了草酸氢根离子的电离,$\frac{c(N{a}^{+})}{c(H{C}_{2}{O}_{4}^{-})}$减小,故正确;
故答案为:bd;
(5)根据反应方程式可知,酸性强弱顺序为:H2C2O4>H2SO3>HC2O4->HSO3-,酸性越强,K越大,故K1>K3>K2>K4,
故答案为:K1>K3>K2>K4.
点评 本题考查了化学反应速率、化学平衡移动及平衡状态的判断、盐类水解、酸性强弱等知识,难度较大,综合性强,很容易失分,只有扎实的基础知识才能顺利解决问题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 天然气隔绝空气高温分解生成炭黑和氢气 | |
| B. | 石油分馏得到汽油、煤油和柴油 | |
| C. | 石油裂解得到乙烯、丙烯、丁二烯 | |
| D. | 煤干馏生成焦炭、煤焦油、焦炉气和粗氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
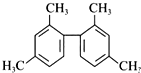
| A. | 该物质所有原子均可共面 | |
| B. | 分子中至少有10个碳原子处于同一平面上 | |
| C. | 分子中至少有11个碳原子处于同一平面上 | |
| D. | 该有机物苯环上的一溴代物有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
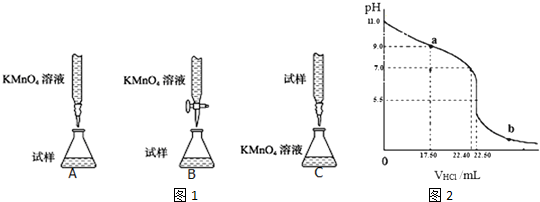
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
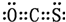 ;碳原子核外电子的轨道表达式为
;碳原子核外电子的轨道表达式为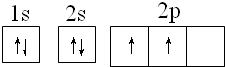 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
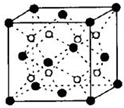 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水,当电路中转移0.2mol电子时,可得到标准状况下4.48L气体 | |
| B. | 若△H<0,△S<0,则反应A+2B═C+D低温时可能自发进行 | |
| C. | 相同条件下,溶液中等浓度的Fe3+、Cu2+、Zn2+的氧化性依次减弱 | |
| D. | 其它条件不变,增大压强,一定能加快反应速率并提高反应物的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
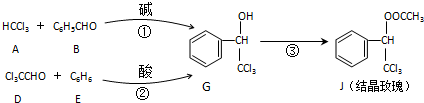

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子云伸展方向与电子的能量大小是无关的 | |
| B. | 只含极性键的分子一定是极性分子 | |
| C. | 氢键是一种特殊的化学键,它广泛地存在于自然界中 | |
| D. | H-O键键能为462.8 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×462.8 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com