
【题目】按要求回答下列问题:
(1)取3.0 g有机物X,完全燃烧后生成3.6 g水和3.36 L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为30,求该有机物的分子式________。X的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是_____(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(2) 中的含氧官能团名称是________。
中的含氧官能团名称是________。
(3)分子式为C6H12 的某烃的所有碳原子都在同一平面上,则该烃的结构简式为________,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为___________。
(4)肉桂酸苯甲酯G是一种香料,主要用于配制人造龙涎香,也可作皂用、化妆用及食用香精的调香原料。如图是用乙烯和甲苯为原料合成肉桂酸苯甲酯的路线图。

已知:RCHO+CH3COOR'![]() RCH=CHCOOR'。回答下列问题:
RCH=CHCOOR'。回答下列问题:
①A的结构简式是________,F的分子式是___________。
②C生成D的化学方程式是____________。
③D生成E的反应类型是__________。
④含有苯环,与D互为同分异构体的有机物有_____种(不考虑立体异构),其中不能与Na反应的结构简式是___________。
⑤G的结构简式是______________。
【答案】C3H8O c 羰基、酯基 (CH3)2C=C(CH3)2 CH3C≡CCH3 CH3CH2OH或C2H5OH C9H10O2 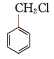 +NaOH
+NaOH![]()
![]() +NaCl 氧化反应 4
+NaCl 氧化反应 4 ![]()
![]()
【解析】
![]() 根据相对密度可知有机物相对分子质量为60,再计算有机物X、二氧化碳、水的物质的量,根据原子守恒计算X分子中C、H原子数目,结合相对分子质量计算确定O原子数目,进而确定有机物X的分子式。互为同分异构体的物质,含有的元素相同,含有的基团、H原子种类、高能分解碎片不同;
根据相对密度可知有机物相对分子质量为60,再计算有机物X、二氧化碳、水的物质的量,根据原子守恒计算X分子中C、H原子数目,结合相对分子质量计算确定O原子数目,进而确定有机物X的分子式。互为同分异构体的物质,含有的元素相同,含有的基团、H原子种类、高能分解碎片不同;![]() 由结构可知,含有的含氧官能团有:酯基、羰基;
由结构可知,含有的含氧官能团有:酯基、羰基;![]() 分子式为
分子式为![]() 的某烃的所有碳原子都在同一平面上,理解为乙烯中4个H原子被4个甲基替代。若分子式为
的某烃的所有碳原子都在同一平面上,理解为乙烯中4个H原子被4个甲基替代。若分子式为![]() 的某烃中所有的碳原子都在同一条直线上,则理解为乙炔中2个H原子被2个甲基替代;
的某烃中所有的碳原子都在同一条直线上,则理解为乙炔中2个H原子被2个甲基替代;![]() 乙烯与水发生加成反应生成A为
乙烯与水发生加成反应生成A为![]() ,结合B的分子式,可知乙醇氧化生成B为
,结合B的分子式,可知乙醇氧化生成B为![]() ;甲苯与氯气在光照条件下发生甲基上取代,结合C的分子式可知C为
;甲苯与氯气在光照条件下发生甲基上取代,结合C的分子式可知C为![]() ;C发生水解反应生成D为
;C发生水解反应生成D为![]() ;乙酸与苯甲醇发生酯化反应生成F为
;乙酸与苯甲醇发生酯化反应生成F为![]() ;由E的分子式,可知D氧化生成E为
;由E的分子式,可知D氧化生成E为![]() ;由G的分子式、结合给予的反应信息,可知G为
;由G的分子式、结合给予的反应信息,可知G为![]() ,据此解答。
,据此解答。
(1)X蒸汽对氢气的相对密度为30,则![]() ,
,![]() ,
,![]() ,
,![]() ,所以,有机物X分子中:
,所以,有机物X分子中:![]() ,
,![]() ,
,![]() ,故有机物X的分子式为:
,故有机物X的分子式为:![]() 。X的同分异构体在质谱仪中的高能碎片不同,在红外光谱中的基团、化学键不完全相同,在核磁共振仪中峰的组数和面积比不同,而元素种类完全相同,c满足,故答案为:C3H8O;c;
。X的同分异构体在质谱仪中的高能碎片不同,在红外光谱中的基团、化学键不完全相同,在核磁共振仪中峰的组数和面积比不同,而元素种类完全相同,c满足,故答案为:C3H8O;c;
(2)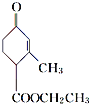 中的含氧官能团名称是羰基和酯基,故答案为:羰基、酯基;
中的含氧官能团名称是羰基和酯基,故答案为:羰基、酯基;
(3)分子式为![]() 的某烃的所有碳原子都在同一平面上,理解为乙烯中4个H原子被4个甲基替代,该烯烃的结构简式为:
的某烃的所有碳原子都在同一平面上,理解为乙烯中4个H原子被4个甲基替代,该烯烃的结构简式为:![]() ,若分子式为
,若分子式为![]() 的某烃中所有的碳原子都在同一条直线上,则理解为乙炔中2个H原子被2个甲基替代,该烃的结构简式为:
的某烃中所有的碳原子都在同一条直线上,则理解为乙炔中2个H原子被2个甲基替代,该烃的结构简式为:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(4)![]() 由上述分析可知,A是乙醇,其结构简式是:CH3CH2OH或C2H5OH,F的结构简式为
由上述分析可知,A是乙醇,其结构简式是:CH3CH2OH或C2H5OH,F的结构简式为![]() ,F的分子式是:
,F的分子式是:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;![]() 生成D为Cl的水解,化学方程式是:
生成D为Cl的水解,化学方程式是: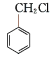 +NaOH
+NaOH![]()
![]() +NaCl,
+NaCl,
故答案为: +NaOH
+NaOH![]()
![]() +NaCl;
+NaCl;
![]() 生成E是苯甲醇发生氧化反应生成苯甲醛,故答案为:氧化反应;
生成E是苯甲醇发生氧化反应生成苯甲醛,故答案为:氧化反应;![]() 含有苯环,与
含有苯环,与![]()
![]()
![]() 互为同分异构体,可以含有一个取代基为
互为同分异构体,可以含有一个取代基为![]() ,可以含有2个取代基为:
,可以含有2个取代基为:![]() 、
、![]() ,有邻、间、对3种,故共有4种,其中不能与Na反应的结构简式是
,有邻、间、对3种,故共有4种,其中不能与Na反应的结构简式是![]() ,故答案为:4;
,故答案为:4;![]() ;
;![]() 由上面的分析可知,G的结构简式是:
由上面的分析可知,G的结构简式是:![]() ,故答案为:
,故答案为:![]() 。
。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1mol/L 的CH3COOH 溶液中有1% CH3COOH 分子发生电离,则溶液的pH=______________;可以使0.10mol·L-1 CH3COOH的电离程度增大的是____________。、
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1. d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH 均等于3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液有锌粉剩余,则生成氢气的体积:V( 盐酸)________V(醋酸)(填“>”、“ <” 或“=”)。
(3)0.1mol/L 的某酸H2A 的pH=4,则H2A 的电离方程式为_________________。
(4)某温度下,Kw=1×10-12,将0.02mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混和液的pH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物和硫的氧化物是主要的大气污染物,烟气脱硫脱硝是环境治理的热点问题。回答下列问题:
(1)目前柴油汽车都用尿素水解液消除汽车尾气中的NO,水解液中的NH3将NO还原为无害的物质。该反应中氧化剂与还原剂物质的量之比为___。
(2)KMnO4/CaCO3浆液可协同脱硫,在反应中MnO4-被还原为MnO42-。
①KMnO4脱硫(SO2)的离子方程式为___。
②加入CaCO3的作用是___。
③KMnO4/CaCO3浆液中KMnO4与CaCO3最合适的物质的量之比为___。
(3)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液pH对脱硫脱硝的影响如图所示:

图a和图b中可知脱硫脱硝最佳条件是___。图b中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种绿色氧化剂,具有高效的杀菌消毒作用,常用于饮水处理,在许多领域展现出广阔的应用前景。制备高铁酸钾有下列两种方法:
方法一:Fe2O3 + KNO3 + KOH===== K2FeO4 + KNO2 + H2O (未配平)
方法二:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+ 5H2O
(1)配平方法一的化学方程式___,再用双线桥标明电子转移的方向和数目___:
___Fe2O3 +___KNO3 +___KOH == ___ K2FeO4 +___ KNO2 +___ H2O
(2)方法二中的还原产物为_________ (写化学式),将方法二的化学方程式改写为离子方程式 ________ ,根据反应方程式,氧化性:KClO ________ K2FeO4(填“>”、“<”或“=”);
(3)利用方法二制备K2FeO4,若有0.5mol K2FeO4生成,转移的电子数为___________ ;
(4)在酸性溶液中,某反应的反应物和生成物有KBiO3、K2SO4、H2SO4、MnSO4、H2O、Bi2(SO4)3 和一种未知物质M。
①已知MnSO4在反应中失去电子,则该反应的氧化剂是________;
②已知该反应中被氧化的元素与被还原的元素的物质的量之比为2:5,则M的化学式为______;
③写出该反应的离子反应方程式________;
④某同学向上述反应后的溶液中逐滴加入FeSO4溶液,测得溶液中M的物质的量与FeSO4的物质的量之间的关系如图所示。已知氧化性:Fe3+>Bi3+,且a点时溶液中含Fe3+、Mn2+,则原反应体系中,起始加入的KBiO3的物质的量为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A.Na+、Fe3+、NO3-、Cl2都可在该物质的溶液中大量共存
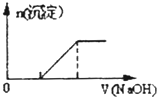
B.向0.1mo1·L-1该物质的溶液中滴加0.1mol·L-1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D.向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为:Fe2++2SO42-+3Ba2++2OH-=2BaSO4↓+Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。

(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和___。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中定有___气体产生,写出D中发生反应的离子方程式__。若去掉C,是否能得出同样结论并解释其原因___。
(3)为验证A中残留物是否含有FeO,需要选用的试剂有___。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
(4)已知分解产物中的某气体能使紫色石蕊试液变蓝,该气体被氧气连续氧化为红棕色气体,第一步催化氧化的化学反应方程式为:__。
(5)上述红棕色气体易溶于水,当该气体与氧气按5:1的体积比混合后装满试管倒置于水中,待液面稳定后试管中的气体体积变为原体积的__。
(6)E中收集到的气体只有N2,其物质的量为xmol,固体残留物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,根据氧化还原反应的基本规律,x、y和z应满足的关系为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中所含氧原子的物质的量相同的是( )
A.0.3mol O2和0.3mol H2OB.![]() 个
个![]() 与0.1mol
与0.1mol ![]()
C.0.1mol ![]() 与0.15mol
与0.15mol ![]() D.0.1mol
D.0.1mol ![]() 与0.1mol
与0.1mol ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细菌冶金是近年来新兴的绿色冶金工艺,它主要是应用细菌法溶浸贫矿、废矿、尾矿和炉渣等,以回收某些贵重有色金属和稀有金属,节约矿产资源,最大限度地利用矿藏的一种冶金方法。其中细菌治铜的生产流程为:
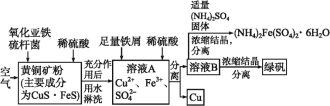
(1)上述生产流程中有三步用到了同一种分离方法,实验室中不能用这种分离方法来分离液态胶体中分散质的原因是___。
(2)绿矾(FeSO4·7H2O)是一种良好的还原剂,也可用来制取治疗缺铁性贫血的药剂和食品调味剂。在保存绿矾时,必须___。在溶液B中加入适量(NH4)2(SO4)2固体,加热浓缩时,可以得到(NH4)2Fe(SO4)4·6H2O的原因是___。
(3)溶液B中一定含有的金属阳离子是___。若在溶液A中加入少量铁屑只发生其中的一个反应,则此反应的平衡常数的表达式为___。
(4)写出黄铜矿中的CuS·FeS在氧化亚铁硫杆菌作用下被空气氧化生成溶液A的离子方程式:___。
(5)氧化亚铜可用作船底防污漆,以杀死低级海生动物而保护船体,也可用作陶瓷和搪瓷的着色剂和红色玻璃的染色剂,氧化亚铜也是一种重要的半导体材料。请用浓的强碱溶液,根据反应2Cu+H2O![]() Cu2O+H2↑,设计出工业生产氧化亚铜的一种方法:___(只要求画实验装置图,其他必要材料任选)。
Cu2O+H2↑,设计出工业生产氧化亚铜的一种方法:___(只要求画实验装置图,其他必要材料任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com