
【题目】铜与浓硫酸反应结束后,烧瓶中铜片未完全溶解。若向反应后的溶液中加入下列物质,相关推断错误的是( )
A.加入铁粉,铁粉溶解B.滴入NaNO3溶液,铜片不溶解
C.加入银粉,银粉不溶解D.滴入NaHCO3溶液,有气体产生
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】(1)某学校实验室从化学试剂商店买回18.4 mol·L-1的硫酸。现用该浓硫酸配制100 mL 1 mol·L-1的稀硫酸。配制100 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为____mL(保留一位小数),量取浓硫酸时应选用________(填字母)规格的量筒。
A.10 mL B.50 mL C.100 mL
(2)取50 mL Na2CO3、Na2SO4的混合溶液,加入过量的BaCl2溶液后得29.02g白色沉淀,用过量的稀硝酸处理后沉淀量减少到9.32g,并有气体放出。试计算:
①原混合物中Na2SO4物质的量浓度为____________;
②产生的气体在标准状况下的体积为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(1)H2O(g) = H2O(l) ΔH1=-Q1 kJ·mol-1
(2)CH3OH(g) = CH3OH(l) △H2=-Q2 kJ·mol-1
(3)2CH3OH(g) +3O2(g) = 2CO2(g)+4H2O(g) △H3=-Q3 kJ·mol-1
(Q1、Q2、Q3均大于0)若要使1mol液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
A. Q1+ Q2 + Q3 B. 0.5Q3-Q2+2Q1 C. Q3-2Q2+4Q1 D. 0.5(Q1+Q2+Q3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定条件下合成氨反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
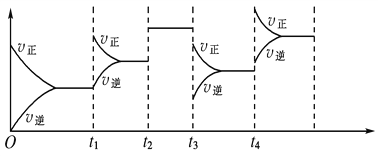
t1________________; t2______________; t3________________; t4______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO、SiO2等氧化物杂质)制取金属锌的流程如图所示。回答下列问题:

(1)ZnFe2O4中Fe的化合价为______价,已知ZnFe2O4能溶于酸,则酸浸时ZnFe2O4反应的离子方程式为_________________________,酸浸后滤渣的成分主要是__________。
(2)酸浸时一般要将锌焙砂粉碎,其目的是提高酸浸效率,为达到这一目的,还可以采用的方法是___________________(任答一条即可)
(3)净化Ⅰ中H2O2参与反应的离子方程式为_________________________________,试剂X的作用是_______________,
(4)净化Ⅱ中得到的Y是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,下列可逆反应达到化学平衡:2NO2 (g) ![]() N2O4 (g) ,ΔH < 0,要使混合气体的颜色加深,可以采取的方法是( )
N2O4 (g) ,ΔH < 0,要使混合气体的颜色加深,可以采取的方法是( )
A. 降低温度 B. 充入适量N2
C. 缩小体积,增大压强 D. 增大体积,减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
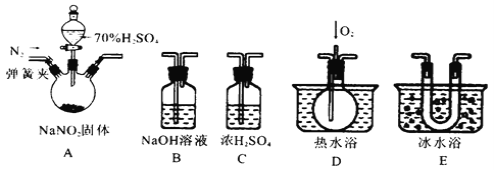
已知:① NO+NO2+2OH-=2NO2-+H2O
② 气体液化的温度:NO2(21℃)、NO(–152℃)
(1)反应前应打开弹簧夹,先通入一段时间氮气,目的是________________________。
(2)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→_____________;组装好仪器后,接下来进行的操作是________________。
(3)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后,A中产生红棕色气体。
① 确认A中产生气体含有NO,依据的现象是_____________________________。
② 装置E的作用是_______________________________________________________。
(4)如果没有装置C,对实验结论造成的影响是______________________________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X,Y,Z,M,N均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4;M原子的最外层电子数与次外电子数之比为3:4;N﹣与Ar原子电子层结构相同;X是短周期主族元素中原子半径最小的;Z是短周期主族元素中原子半径最大的;化合物XN常温下为气体.据此回答:
(1)N的最高价氧化物对应水化物的化学式是 .
(2)Z与M形成的化合物水溶液显碱性,其原因是(用离子方程式表示).
(3)X与Y,X与M均可形成18电子分子,这两种分子在水溶液中反应可观察到的现象是 , 反应的化学方程式是 .
(4)由X,Y,Z,M四种元素组成一种强酸的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 .
(5)Y,Z,N形成的化合物的水溶液中离子浓度的大小顺序是 .
(6)如图所示: 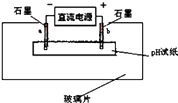
取一张用ZN溶液浸湿的pH试纸平铺在玻璃片上,取两根石墨棒做电极,接通直流电源.一段时间后,a电极处的pH试纸上可观察到的现象是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com