
密闭容器中发生下列反应aA(g)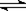 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.A的转化率变小 B.平衡向正反应方向移动
C.D的体积分数变大 D.a > c+d
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
下列溶液中,跟100mL0.5mol/LNaCl溶液所含的Cl-物质的量浓度相同的是
A、100mL0.5mol/LMgCl2溶液 B、200mL0.25mol/LNaCl溶液
C、50mL1mol/LNaCl溶液 D、25mL0.5mol/LHCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关系式能说明可逆反应N2(g)+3H2(g)  2NH3(g)已达平衡的是
2NH3(g)已达平衡的是
A、3v正( N2)=v正( H2) B、v正( N2)=v逆( NH3)
C、2v正( H2)=3v逆( NH3) D、v正( N2)=3v逆( H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,可逆反应C(s) + CO2(g)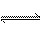 2CO(g) △H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
2CO(g) △H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
A、①②③④ B、①③ C、①②③ D、①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B两个起始容积相等的恒温密闭容器,A保持恒压,B保持恒容。起始时向A、B中均通入2molSO2和1molO2后,在一定条件下反应达到平衡。则下列说法中不正确的是
A.达到平衡时,SO2的转化率:A>B
B.起始时的反应速率:A=B,反应完成时的平均速率:A>B
C.达到平衡后再充入等量氩气,A、B中平衡均不发生移动
D.达到平衡后再向A中充入等量的原反应气体,再次平衡时SO2的质量分数与前次相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L密闭容器中,充入1 mol N2和3mol H2,一定条件下发生合成氨反应,2min时达到平衡。测得平衡时N2的转化率为40%,求:
(1)NH3的平衡浓度
(2)求该温度下的平衡常数K(分别用N2、H2、NH3的浓度表示,不用计算出结果)
(3)H2在平衡混合气体中的体积分数
(4)平衡时容器的压强与起始时压强之比
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1∶9 B.1∶1 C.1∶2 D.1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;
② 用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是 。
(2)用pH试纸测定HA溶液pH的操作方法为 。
(3)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
(4)乙方案中,说明HA是弱电解质的现象是 (选填编号)。
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com