
����Ŀ����֪: RX��Mg![]() RMgX (RXΪ±������XΪ±��ԭ�ӣ�,���ɵ�±������þ������ʻ��ṹ�Ļ����ȩ��ͪ�ȣ�������Ӧ����ˮ����ܺϳɸ���ָ���ṹ�Ĵ���
RMgX (RXΪ±������XΪ±��ԭ�ӣ�,���ɵ�±������þ������ʻ��ṹ�Ļ����ȩ��ͪ�ȣ�������Ӧ����ˮ����ܺϳɸ���ָ���ṹ�Ĵ���

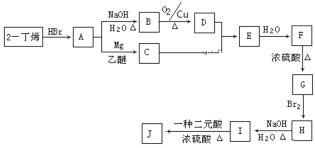
����2����ϩ�ͱ�Ҫ������Ϊԭ�Ϻϳ�F�������ϳ�һ�ַ���ʽΪC10H16O4�ľ�����Ԫ��������J���ϳ���·���£�(G�ĺ˴Ź��������������)
�밴Ҫ����գ�
��1��F��ϵͳ������___________________________��E�Ľṹ��ʽ��_________________________
��2��C��E�ķ�Ӧ������______________��F��G�ķ�Ӧ������___________________
��3��д��I��J��ѧ��Ӧ����ʽ��___________________________________________
��4��A��ͬ���칹�干��______��
��5��MΪD��ͬ���칹�����ܷ���������Ӧ,д������M�Ľṹ��ʽ_______________;���к˴Ź��������г���3��������������������ͭ����Һ����������·�����Ӧ�ķ���ʽΪ:______________________________________��
���𰸡�3��4��������3������ ![]() �ӳɷ�Ӧ ��ȥ��Ӧ
�ӳɷ�Ӧ ��ȥ��Ӧ 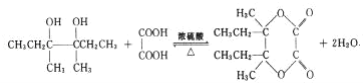 3
3 ![]() ��CH3CH2CH2CHO��
��CH3CH2CH2CHO�� ![]() +NaOH+2Cu(OH)2
+NaOH+2Cu(OH)2![]()
![]() +Cu2O��+3H2O
+Cu2O��+3H2O
��������
2����ϩ��HBr�����ӳɷ�Ӧ�õ�AΪ![]() ��A����������ˮ��Һ�����������·���±����ˮ�ⷴӦ�õ�BΪ
��A����������ˮ��Һ�����������·���±����ˮ�ⷴӦ�õ�BΪ![]() ��B��������������DΪ
��B��������������DΪ![]() ��A������Ϣ�з�Ӧ����CΪ
��A������Ϣ�з�Ӧ����CΪ![]() �������Ϣ��֪C��D�����ӳɷ�Ӧ����EΪ
�������Ϣ��֪C��D�����ӳɷ�Ӧ����EΪ![]() ��E����ˮ�ⷴӦ����FΪ
��E����ˮ�ⷴӦ����FΪ![]() ��������Ϊ3��4��������3��������F������ȥ��Ӧ����G��G�ĺ˴Ź�������������壬��GΪ
��������Ϊ3��4��������3��������F������ȥ��Ӧ����G��G�ĺ˴Ź�������������壬��GΪ![]() ��G���巢���ӳɷ�Ӧ����HΪ
��G���巢���ӳɷ�Ӧ����HΪ ��H����ˮ�ⷴӦ�õ�IΪ
��H����ˮ�ⷴӦ�õ�IΪ ��I�Ͷ�Ԫ�ᷢ��������Ӧ���ɷ���ʽΪC10H16O4�ľ�����Ԫ��������J���ö�Ԫ�Ậ��2��̼ԭ�ӣ���ΪHOOC��COOH����J�Ľṹ��ʽΪ
��I�Ͷ�Ԫ�ᷢ��������Ӧ���ɷ���ʽΪC10H16O4�ľ�����Ԫ��������J���ö�Ԫ�Ậ��2��̼ԭ�ӣ���ΪHOOC��COOH����J�Ľṹ��ʽΪ ���ݴ˽��
���ݴ˽��
2����ϩ��HBr�����ӳɷ�Ӧ�õ�AΪ![]() ��A����������ˮ��Һ�����������·���±����ˮ�ⷴӦ�õ�BΪ
��A����������ˮ��Һ�����������·���±����ˮ�ⷴӦ�õ�BΪ![]() ��B��������������DΪ
��B��������������DΪ![]() ��A������Ϣ�з�Ӧ����CΪ
��A������Ϣ�з�Ӧ����CΪ![]() �������Ϣ��֪C��D�����ӳɷ�Ӧ����EΪ
�������Ϣ��֪C��D�����ӳɷ�Ӧ����EΪ![]() ��E����ˮ�ⷴӦ����FΪ
��E����ˮ�ⷴӦ����FΪ![]() ��������Ϊ3��4��������3��������F������ȥ��Ӧ����G��G�ĺ˴Ź�������������壬��GΪ
��������Ϊ3��4��������3��������F������ȥ��Ӧ����G��G�ĺ˴Ź�������������壬��GΪ![]() ��G���巢���ӳɷ�Ӧ����HΪ
��G���巢���ӳɷ�Ӧ����HΪ ��H����ˮ�ⷴӦ�õ�IΪ
��H����ˮ�ⷴӦ�õ�IΪ ��I�Ͷ�Ԫ�ᷢ��������Ӧ���ɷ���ʽΪC10H16O4�ľ�����Ԫ��������J���ö�Ԫ�Ậ��2��̼ԭ�ӣ���ΪHOOC��COOH����J�Ľṹ��ʽΪ
��I�Ͷ�Ԫ�ᷢ��������Ӧ���ɷ���ʽΪC10H16O4�ľ�����Ԫ��������J���ö�Ԫ�Ậ��2��̼ԭ�ӣ���ΪHOOC��COOH����J�Ľṹ��ʽΪ ��
��
��1��������������֪��F������Ϊ3��4��������3��������E�Ľṹ��ʽΪ![]() ���ʴ�Ϊ��3��4��������3��������
���ʴ�Ϊ��3��4��������3��������![]() ��
��
��2��C��E�ķ�Ӧ�����ǣ��ӳɷ�Ӧ��F��G�ķ�Ӧ�����ǣ���ȥ��Ӧ���ʴ�Ϊ���ӳɷ�Ӧ����ȥ��Ӧ��
��3��I��J��ѧ��Ӧ����ʽ��  ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��4��AΪ![]() ����ͬ���칹����CH3CH2CH2CH2Br����CH3��2CHCH2Br����CH3��3CBr������3�֣��ʴ�Ϊ��3��
����ͬ���칹����CH3CH2CH2CH2Br����CH3��2CHCH2Br����CH3��3CBr������3�֣��ʴ�Ϊ��3��
��5��DΪ![]() ��MΪD��ͬ���칹�����ܷ���������Ӧ˵��M�к���ȩ���������������M�Ľṹ��ʽ
��MΪD��ͬ���칹�����ܷ���������Ӧ˵��M�к���ȩ���������������M�Ľṹ��ʽ![]() ��CH3CH2CH2CHO�����к˴Ź��������г���3��������Ϊ��һ�ֽṹ����������������ͭ����Һ����������·�����Ӧ�ķ���ʽΪ
��CH3CH2CH2CHO�����к˴Ź��������г���3��������Ϊ��һ�ֽṹ����������������ͭ����Һ����������·�����Ӧ�ķ���ʽΪ![]() +NaOH+2Cu(OH)2
+NaOH+2Cu(OH)2![]()
![]() +Cu2O��+3H2O���ʴ�Ϊ��
+Cu2O��+3H2O���ʴ�Ϊ��![]() ��CH3CH2CH2CHO��
��CH3CH2CH2CHO��![]() +NaOH+2Cu(OH)2
+NaOH+2Cu(OH)2![]()
![]() +Cu2O��+3H2O��
+Cu2O��+3H2O��


 ������ȫ�̼����ĩ���100��ϵ�д�
������ȫ�̼����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2L�ܱ�������X��Y��Z������̬���ʵ����ʵ���(n)��ʱ��(t)�仯��������ͼ��ʾ����ͼ������

(1)�÷�Ӧ�Ļ�ѧ����ʽΪ______________��
(2)��Ӧ��ʼ��2min����Z��ʾ��ƽ����Ӧ����Ϊ_________��
(3)����������˵��������Ӧ�ﵽ��ѧƽ��״̬����________(�����)
A.�������������ʵ�������ʱ��ı仯���仯
B.��������ѹǿ����ʱ��ı仯���仯
C.��λʱ����ÿ����![]() X��ͬʱ����
X��ͬʱ����![]() Z
Z
D.������������������ʱ��ı仯���仯
E.���������ܶȲ��ٷ����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������Ĺؼ��ǰ��Ĵ������������Ṥҵ��صĹ����в����ĵ�������NOx(NO��NO2�Ļ������費��N2O4)�Ĵ�����Ӧ��Ҳ�ǿ�ѧ�о����ȵ㡣
�Ź�ҵ�Ͽ��ð������շ�����NOx����Ӧԭ��Ϊ4xNH3+6NOx![]() (2x+3)N2+6xH2O��ij��ѧ��ȤС��ģ��ô������̵�ʵ��װ����ͼ��ʾ��
(2x+3)N2+6xH2O��ij��ѧ��ȤС��ģ��ô������̵�ʵ��װ����ͼ��ʾ��
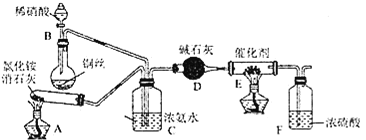
��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ________��
��װ��D�м�ʯ�ҵ�������________��
�ƹ�ҵ��Ҳ����Na2CO3��Һ���շ�����NOx(��֪��NO������Na2CO3��Һ��Ӧ)��NO+NO2+ Na2CO3 = 2 NaNO2+ CO2��
2NO2+ Na2CO3 = NaNO2+ NaNO3+ CO2��
�ٵ�NOx��Na2CO3��Һ��ȫ����ʱ��x��ֵ��������________![]() ��ѡ����ĸ
��ѡ����ĸ![]() ��
��
A.1.4 B.1.6 C.1.8
�ڽ�1 mol NOxͨ��Na2CO3��Һ�У�����ȫ����ʱ����Һ�����ɵ�NO3����NO2���������ӵ����ʵ�����x�仯��ϵ��ͼ��ʾ��

ͼ���߶�a��ʾ________![]() �ѧʽ
�ѧʽ![]() ��xֵ�ı仯��ϵ������������������Ϊ21.2%��Na2CO3��Һ���գ�����ҪNa2CO3��Һ����________g��
��xֵ�ı仯��ϵ������������������Ϊ21.2%��Na2CO3��Һ���գ�����ҪNa2CO3��Һ����________g��
![]() ��������Na2CO3��Һ��ȫ����NOx��ÿ����22.4 L(��״��)CO2(ȫ���ݳ�)ʱ������Һ����������44g����NOx�е�
��������Na2CO3��Һ��ȫ����NOx��ÿ����22.4 L(��״��)CO2(ȫ���ݳ�)ʱ������Һ����������44g����NOx�е�![]() ________��
________��
�ǰ������շ���Na2CO3��Һ���շ�����NOxβ����������________��
������Ҳ���������մ���NOx���䷴Ӧԭ��ΪNO+NO2+ H2O = 2HNO2��2HNO2+CO(NH2)2 = 3H2O + CO2��+ 2N2���������������NO��NO2��������Ӧ��ϵ����ʱ����Ч����ѡ������������V(NO):V(NO2)=5:1ʱ����ͨ��һ�����Ŀ�����ͬ��ͬѹ�£�V(����):V(NO)= ________ (������O2���������ԼΪ20%)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijŨ��NaOH��Һ�ζ�һԪ��HA�ĵζ�������ͼ��ʾ(������Ϊ����NaOH�������������Ϊ���û��Һ��pH�����ȱ�ɫ��ΧΪ3.1��4.4)�������ж���ȷ����

A.HA��Ũ��Ϊl��10-4mol��L-1
B.ʵ��ʱ��ѡ������ָʾ��
C.V��10mL�����ǡ���к�
D.pH��7ʱ����Һ��c(Na+)��c��A-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƽ�ⳣ��(��Ka��ʾ)�Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��
��ѧʽ | HF | H2CO3 | HClO |
����ƽ�� ����(Ka) | 7.2��10-4 | K1=4.4��10-7 K2=4.7��10-11 | 3.0��10-8 |
(1)��Ũ��Ϊ0.1mol��L-1HF��Һ��ˮϡ��һ��(�����¶Ȳ���)�����и����������___��
A��c(H+) B��c(H+)��c(OH-) C��![]() D��
D��![]()
(2)25��ʱ����20mL0.1mol��L-1������м���VmL0.1mol��L-1NaOH��Һ����û����Һ��pH�仯������ͼ��ʾ������˵����ȷ����___��
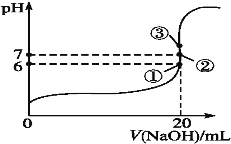
A��pH=3��HF��Һ��pH=11��NaF��Һ�У���ˮ�������c(H+)���
B���ٵ�ʱpH=6����ʱ��Һ��c(F-)-c(Na+)=9.9��10-7mol��L-1
C���ڵ�ʱ����Һ�е�c(F-)=c(Na+)
D���۵�ʱV=20mL����ʱ��Һ��c(F-)<c(Na+)=0.1mol��L-1
(3)���ʵ���Ũ�Ⱦ�Ϊ0.1mol��L-1������������Һ����Na2CO3��Һ����NaHCO3��Һ����NaF��Һ����NaClO��Һ�����������ж�pH�ɴ�С����___��
(4)Na2CO3��Һ�Լ�������Ϊ![]() ˮ���Ե�ʣ�����Ƽ�ʵ����ʵ֤֮___��
ˮ���Ե�ʣ�����Ƽ�ʵ����ʵ֤֮___��
(5)����������һֱ��Ϊ���ĺ�������ڡ�1971��������ѧ���÷���ͨ��ϸ��ĩʱ���HFO��ṹʽΪH-O-F��HFO��ˮ��Ӧ�õ�HF�ͻ�����A��ÿ����1molHFת��___mol���ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1molL-1NaOH��Һ��ε���10mL0.1molL-1NH4HSO4��Һ�У���Һ��pH��NaOH��Һ�����ϵ��ͼ��ʾ�����й�ϵ�У�����ȷ����
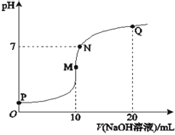
A.M��c(Na+)��c(NH4+)
B.N��c(NH4+)+c(Na+)=2c(SO42-)
C.Q��c(NH4+)+c(NH3H2O)=c(Na+)
D.M��N��Q�����У�ˮ�ĵ���̶�M��N��Q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾһЩ�����е�ijЩ�ṹ����ش��������⣺

��1���������ʯ����(������ĸ����ͬ)___������ÿ��̼ԭ����____��̼ԭ������Ҿ�����ȡ����ʯ����____���塣
��2������ʯī����____��ÿ����������ռ�е�̼ԭ����ƽ��Ϊ____����
��3������NaCl����___��ÿ��Na����Χ��������Ҿ�����ȵ�Na����___����
��4������CsCl����___��������____���壬ÿ��Cs����____��Cl�����ڡ�
��5�������ɱ�����___��������___���壬ÿ��CO2������___��CO2���ӽ��ڡ�
��6����֪ʯī��̼̼���ļ����Ƚ��ʯ��̼̼���ļ����̣����������������۵��ɸߵ��͵�����˳��Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��� 0.1mol/LNa2A��Һ�в���ͨ��HCl��H2A��HA-��A2-����Һ����ռ���ʵ��������� pOH[pOH=-lgc(OH-)]�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��

A. H2A�ĵڶ�������ƽ�ⳣ��Ϊ10-10
B. ����HCl��ͨ�� c(H+)/c(H2A)�ȼ�С������
C. ����Һ������ʱ:c(Na+)=c(HA-)+2c(A2-)
D. ����Ũ�ȵ������ Na2A��H2A��Һ��Ϻ���Һ�Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ��װ�ú�������Ҫ��������Ʒ���������ʵ�顣

��֪2NH3+3CuO![]() N2+3Cu+3H2O����ʵ��֤���������л�ԭ�ԡ�
N2+3Cu+3H2O����ʵ��֤���������л�ԭ�ԡ�
��1����ʯ�ҵ�������______________������©����������___________________��
��2��Ũ��ˮ�����NaOH�Ӵ������ݳ���������ԭ����______________________��
��3��Ӳ�ʲ������пɹ۲쵽��ʵ��������_________________________________��
��4�������£�����ˮ��ϡ����ǡ����ȫ�кͣ���������Һ�и�����Ũ�ȵĴ�С˳��Ϊ_________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com