
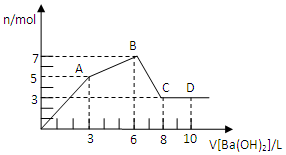
 向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )| A. | 图中C点铝元素存在的形式是[Al(OH)4]- | |
| B. | 向D点溶液中通入过量CO2气体,立即产生白色沉淀 | |
| C. | 原混合溶液中c[Al2(SO4)3]:c(AlCl3)=1:2 | |
| D. | OA段反应的离子方程式为:2Al3++3SO42-+3Ba2++8OH-═2Al(OH)4-+3BaSO4↓ |
分析 向含Al2(SO4)3 和 AlCl3的混合溶液与Ba(OH)2溶液反应的实质是Al3+与OH-、Ba2+与SO42-之间的离子反应,如下:
Ba2++SO42-═BaSO4↓,Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,
假设1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2量为3mol,提供6molOH-,1molAl2(SO4)3中含有2molAl3+,由反应Al3++3OH-═Al(OH)3↓可知,2molAl3+完全沉淀,需要6molOH-,故:
从起点到A点,可以认为是硫酸铝与氢氧化钡恰好发生反应生成硫酸钡、氢氧化铝沉淀,A点时SO42-完全沉淀,
A-B为氯化铝与氢氧化钡的反应,B点时溶液中Al3+完全沉淀,产生沉淀达最大值,溶液中溶质为BaCl2,
B-C为氢氧化铝与氢氧化钡反应,C点时氢氧化铝完全溶解,
A、C点时氢氧化铝完全溶解;
B、D点的溶液中含有Ba2+、AlO2-;
C、前3LBa(OH)2溶液与溶液中Al2(SO4)3反应,从3L-6L为Ba(OH)2溶液与溶液中AlCl3反应,据此计算;
D、OA段实质为Ba(OH)2溶液与溶液中Al2(SO4)3反应.
解答 解:向含Al2(SO4)3 和 AlCl3的混合溶液与Ba(OH)2溶液反应的实质是Al3+与OH-、Ba2+与SO42-之间的离子反应,如下:Ba2++SO42-═BaSO4↓,Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,
假设1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2量为3mol,提供6molOH-,1molAl2(SO4)3中含有2molAl3+,由反应Al3++3OH-═Al(OH)3↓可知,2molAl3+完全沉淀,需要6molOH-,故:
从起点到A点,可以认为是硫酸铝与氢氧化钡恰好发生反应生成硫酸钡、氢氧化铝沉淀,A点时SO42-完全沉淀,
A-B为氯化铝与氢氧化钡的反应,B点时溶液中Al3+完全沉淀,产生沉淀达最大值,溶液中溶质为BaCl2,
B-C为氢氧化铝与氢氧化钡反应,C点时氢氧化铝完全溶解,
A、C点时氢氧化铝完全溶解,转化为偏铝酸盐,故C点铝元素存在形式是AlO2-,故A正确;
B、D点的溶液中含有Ba2+、AlO2-,通入二氧化碳立即产生碳酸钡、氢氧化铝沉淀,故B正确;
C、前3LBa(OH)2溶液与溶液中Al2(SO4)3反应,从3L-6L为Ba(OH)2溶液与溶液中AlCl3反应,二者消耗的氢氧化钡的物质的量相等为3L×1mol/L=3mol,由生成硫酸钡可知3n[Al2(SO4)3]=n[Ba(OH)2],故n[Al2(SO4)3]=1mol,由氯化铝与氢氧化钡生成氢氧化铝可知3n(AlCl3)=2[Ba(OH)2]=6mol,故n(AlCl3)=2mol,故原溶液中原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2,故C正确;
D、OA段实质为硫酸铝与氢氧化钡恰好发生反应生成硫酸钡、氢氧化铝沉淀,反应离子方程式为:
3Ba2++2Al3++6OH-+3SO42-=3BaSO4↓+2Al(OH)3↓,故D错误;
故选D.
点评 本题考查化学反应的有关图象问题、铝化合物性质、混合物的有关计算等,难度较大,关键是清楚各阶段发生的反应,注意从开始到A点相当于是硫酸铝与氢氧化钡的反应生成硫酸钡、氢氧化铝沉淀.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
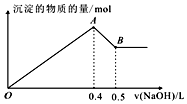 现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )| A. | 1:3 | B. | 3:1 | C. | 2:3 | D. | 6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )| A. | Be、Na、Al | B. | C、Al、P | C. | O、P、Cl | D. | B、Mg、S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物不跟任何酸反应 | |
| B. | 水玻璃敞口存放,能有白色胶状沉淀析出 | |
| C. | 高温时SiO2能跟Na2CO3反应放出CO2,所以硅酸的酸性比碳酸强 | |
| D. | SiO2和CO2化学性质虽然相似,且两者的结构完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.
当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.| 物质 | H2(g) | C(s) | CO(g) |
| 燃烧热KJ/mol | 285.8 | 393.5 | 283.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
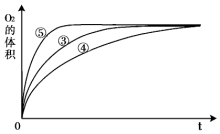 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com