
| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4、振荡、静置 | CCl4层呈橙色 |
| ③ | 取②的上层溶液,加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 将③过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A、肯定含有的离子是①④⑤ |
| B、肯定没有的离子是②⑤⑦ |
| C、可能含有的离子是①②⑥ |
| D、不能确定的离子是①③⑥ |


科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:填空题
(18分)(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)向移动;溶液中 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3 CH3COONa+CO2↑+H2O。
CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_____________________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、X可能含有2种盐 |
| B、Y可能含有(NH4)2SO4 |
| C、a是SO3 |
| D、(NH4)2S2O8中S的化合价不可能为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )| A、Z的氧化物可与Y的氢化物水溶液发生化学反应 |
| B、X的原子半径比As原子半径小,两者原子序数之差为29 |
| C、W的氧化物对应的水化物是共价化合物,并且必是强酸 |
| D、图中五种元素均是非金属元素,并且Y的非金属性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R元素最高价氧化物所对应的水化物具有两性,但不会溶于稀氨水 |
| B、Y分别可与X和Z形成原子个数比为1:1的化合物,且形成的化合物晶体类型相同 |
| C、Y的氢化物分子间存在氢键,因此Y的氢化物的稳定性大于W的氢化物的稳定性 |
| D、原子半径从小到大:X<Y<Z<R<W |
查看答案和解析>>
科目:高中化学 来源: 题型:
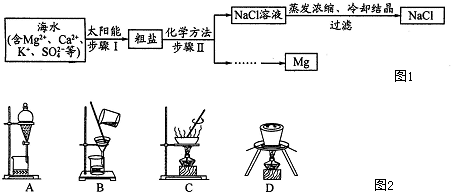
| Bacl2 |
| ① |
| NaOH |
| ② |
| Na2CO3 |
| ③ |
| HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Ca(OH)2溶液中加入过量的NaHCO3溶液Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
| B、向100 mL 0.12 mol/L-1的Ba(OH)2溶液中通入0.02 mol CO2:Ba2++3OH+2CO2=HCO3+BaCO3↓+H2O |
| C、硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D、向含0.1molNaOH和0.1molNa2CO3的溶液中加入1L 0.4mol?L-1稀盐酸OH-+CO32-+3H+=CO2↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉和纤维素均为高分子化合物,两者都是工业制造酒精的原料 |
| B、CH2=CH-CH(CH3)-C≡CH经催化加氢可生成3-甲基戊烷 |
| C、等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减少 |
D、已知苹果酸的结构简式为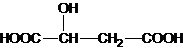 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
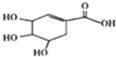
| A、分子式为C7H10O5 |
| B、1mol莽草酸与足量金属钠反应生成2molH2 |
| C、可发生加成反应、取代反应、氧化反应 |
| D、在水溶液中羧基和羟基均能电离出H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com