
| A. | 标准状况下,11.2L C2H6中含有共价键的数目为3.5NA | |
| B. | 通常状况下,2.0 g H2 和1 mol Cl2反应后的气体分子数目为2NA | |
| C. | 1molAl分别与足量的盐酸、足量的NaOH溶液反应,转移的电子数都是3NA | |
| D. | 将3.4g H2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA |
分析 A、在标准状况,依据n=$\frac{V}{Vm}$计算物质的量结合乙烷分子结构计算共价键;
B、H2+Cl2=2HCl,这是一个气体体积不变的反应,故反应前气体分子总数目为2NA,反应后气体分子总数目仍为2NA;
C、据铝反应后变为+3价来分析;
D、求出H2S的物质的量,然后根据H2S溶于水后部分电离为HS-和S2-离子来分析.
解答 解:A、标准状况下,11.2L的 C2H6物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,1mol分子中含有共价键的数目为7NA,故0.5mol分子中含有共价键的数目为3.5NA,故A正确;
B、2.0 g H2相当于1molH2,1molH2和1 mol Cl2气体总分子数目为2NA,H2+Cl2=2HCl,这是一个气体体积不变的反应,故反应前气体分子总数目为2NA,反应后气体分子数目仍为2NA,故B正确;
C、Al与足量的盐酸,足量的NaOH反应,铝均变为+3价,故1mol铝转移3mol电子即3NA个,故C正确;
D、标况下3.4gH2S的物质的量为0.1mol,而H2S是弱电解质,溶于水后只能部分电离为HS-和S2-离子,故所得溶液中的H2S、HS-和S2-离子的个数之和为0.1NA个,故D错误,
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 叙述I | 叙述II |
| A.NH4Cl受热易分解 | 可用加热法除去I2中的NH4Cl |
| B.往氯化钙溶液中通入足量的CO2 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C.水玻璃具有黏性 | 盛装烧碱溶液的试剂瓶不能用玻璃塞 |
| D.利用丁达尔现象区分氢氧化铁胶体和浓的氯化铁溶液 | 往氢氧化钠溶液中滴加饱和氯化铁溶液,加热至红褐色制得胶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 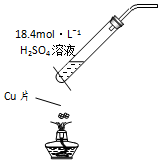 用图装置制取SO2 | |
| B. | 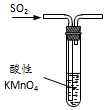 图装置中溶液的颜色变浅,说明SO2具有漂白性 | |
| C. | 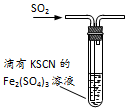 图装置中溶液的颜色变浅,说明SO2具有还原性 | |
| D. |  图装置中产生淡黄色沉淀,说明SO2或H2SO3具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30g C2H6中含有的共用电子对数为6NA | |
| B. | 1.0L 1.0mol•L-1Na3PO4水溶液中含有的氧原子数为4NA | |
| C. | 1 mol FeI2与足量氯气反应转移的电子数为3NA | |
| D. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 军舰船底镶嵌锌块作正极,以防船体被腐蚀 | |
| B. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| C. | 金属冶炼过程是金属离子得电子变成金属单质的氧化过程 | |
| D. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水一种试剂可将苯、四氯化碳、乙烯、乙醇、苯酚鉴别开 | |
| B. | 组成为C4H10O的醇与乙二酸在一定条件下生成二元酯的种类有10种 | |
| C. | 二糖、淀粉、纤维素水解的最终产物都是葡萄糖 | |
| D. | 芥子醇结构简式是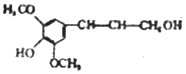 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com