
【题目】将6.5 g锌放入足量的稀硫酸中充分反应,得到80 mL密度为1.25 g/mL的溶液。试计算回答:
①所得溶液中硫酸锌的物质的量浓度为________,质量分数为____。
②生成的气体在标准状况下的体积为________。
【答案】1.25 mol/L 16.1% 2.24L
【解析】
锌与硫酸发生Zn+H2SO4=ZnSO4+H2↑,然后按照物质的量在反应方程式的应用进行分析判断计算;
锌和硫酸反应Zn+H2SO4=ZnSO4+H2↑
65g 1mol 1mol
6.5g 0.1mol 0.1mol
①根据上述分析,ZnSO4的物质的量为0.1mol,则c(ZnSO4)=![]() =1.25mol·L-1;反应后溶液的质量为80mL×1.25g·mL-1=100g,m(ZnSO4)=0.1mol×161g·mol-1=16.1g,则硫酸锌的质量分数为
=1.25mol·L-1;反应后溶液的质量为80mL×1.25g·mL-1=100g,m(ZnSO4)=0.1mol×161g·mol-1=16.1g,则硫酸锌的质量分数为![]() ×100%=16.1%;
×100%=16.1%;
答案为1.25mol·L-1;16.1%;
②根据上述分析,生成氢气的物质的量0.1mol,则标准状况下,生成氢气的体积为0.1mol×22.4L·mol-1=2.24L;
答案为2.24L。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 断裂化学键会释放能量
B. 物质的内能与其聚集状态有关
C. 放热反应均无需加热就能发生
D. 根据能量守恒定律,反应物的总能量等于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定的温度下,将2mol A和3mol B充入一密闭容器中发生如下反应:aA(g)+B(g)![]() C(g)+D(g),5 min后达到平衡。已知该温度下反应的平衡常数K=1,在t0时刻,若保持温度不变将容器的体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
C(g)+D(g),5 min后达到平衡。已知该温度下反应的平衡常数K=1,在t0时刻,若保持温度不变将容器的体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )

A. 正反应是一个体积减小的反应,a=2
B. 速率随时间的变化关系可用上图表示
C. 达平衡时B的转化率为40%
D. 为提高A的转化率,可采取升高温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格列卫是治疗白血病和多种癌症的一种抗癌药物,在其合成过程中的一种中间产物结构表示如下:

下列有关该中间产物的说法不正确的是
A. 分子中可以发生水解反应的官能团有两种
B. 碱性条件下水解的产物之一,含有官能团—NH2
C. 碱性条件下水解的产物之一,经酸化后自身可以发生缩聚反应
D. 水解产物的单个分子中,苯环上都有3种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A. 检验溴乙烷消去反应产物
B. 证明Fe(OH)3比Mg(OH)2更难溶
C. 检验蔗糖的水解产物
D. 探究铁的析氢腐蚀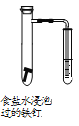
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种清洁能源,用途广泛。
(1)工业上可用焦炉煤气(主要成分为CO、CO2和H2)制备天然气。已知:CO(g)+3H2(g)=CH4(g) +H2O(g) △H1=-206kJ/mol,CO(g)+H2O(g)=H2(g)+CO2(g) △H2= -41kJ/mol。
①CO2转化为CH4的热化学方程式是:_______。
②有利于提高混合气中CH4含量的措施是:_______。
a. 使用催化剂 b. 升高温度 c. 及时导出水蒸气
(2)甲烷可制成燃料电池,其装置如下图所示。

①电极b是_______极(填“正”或“负”)。
②a极的电极反应式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下图,下列叙述正确的是

A. 若该图表示的是活细胞的各化学元素的含量,则甲为碳元素
B. 若该图表示的是细胞各化学元素占干重的百分比,则甲为氧元素
C. 若该图为活细胞的化合物组成情况,则甲中含有的元素为C、H、0
D. 若该图是完全脱水后的细胞的化合物组成情况,则甲是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种“全氢电池”的工作原理如图所示。下列说法正确的是

A. 电流方向是从吸附层M通过导线到吸附层N
B. 离子交换膜可阻止左边的碱性溶液和右边的酸性溶液发生中和
C. Na+从右边穿过离子交换膜向左边移动
D. 正极的电极反应是H2-2e-+2OH-=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com