
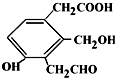
 则Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,消耗Na、NaOH、NaHCO3的物质的量之比为( )
则Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,消耗Na、NaOH、NaHCO3的物质的量之比为( )| A. | 3:3:3 | B. | 3:2:2 | C. | 3:2:1 | D. | 1:1:1 |
分析 该有机物中含有酚羟基、醇羟基、羧基、醛基,具有酚、羧酸、醇、醛的性质,能和Na反应的官能团是醇羟基、酚羟基和羧基,能和NaOH反应的是酚羟基和羧基,能和碳酸氢钠反应的只有羧基,以此解答该题.
解答 解:能和Na反应的官能团是醇羟基、酚羟基和羧基,能和NaOH反应的是酚羟基和羧基,能和碳酸氢钠反应的只有羧基,所以Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,则消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1,
故选C.
点评 本题考查有机物结构和性质,侧重考查分析能力,明确官能团与性质的关系即可解答,熟练掌握常见有机物的官能团及其性质,注意酚羟基和碳酸氢钠不反应但和碳酸钠反应.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠在空气中加热,生成淡黄色固体:2Na+O2═Na2O2 | |
| B. | 向硫酸铝溶液中加入氨水制备氢氧化铝:Al3++3NH3•H2O=Al(OH)3↓+3$N{{H}_{4}}^{+}$ | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O=Fe3O4+H2↑ | |
| D. | 二氧化氮溶于水有硝酸生成:3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
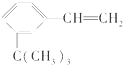 有如下性质:
有如下性质: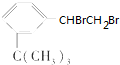 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①、④溶液中水电离的c( H+):①>④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②<③ | |
| C. | 分别向等体积的上述溶液中加入100 ml,水,溶液的pH:③>④>①>② | |
| D. | 将①、④溶液混合后pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SO2在物质的研究和制备过程中有重要的用途,既可以作为原料又可作为溶剂,请回答下列问题:
SO2在物质的研究和制备过程中有重要的用途,既可以作为原料又可作为溶剂,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀时的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.25 mol/(L•min) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v (C)=0.3 mol/(L•min) | D. | v(D)=0.1 mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com