
【题目】纯的叠氮酸(HN3)是一种弱酸,常温下向25mL0.1mol/LNaOH溶液中加入0.2mol/LHN3溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图。下列说法不正确的是( )
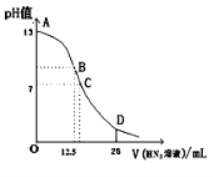
A.该滴定过程中应用酚酞作指示剂
B.若B点pH=8,则c(HN3)=(10-6-10-8)mol/L
C.沿曲线A→B→C的过程中,由水电离产生的c(OH-)逐渐减少
D.点D对应溶液中存在关系:c(N![]() )>c(Na+)>c(HN3)
)>c(Na+)>c(HN3)
【答案】C
【解析】
A.NaOH与HN3等物质的量反应后溶液显碱性,滴定时选择在碱性条件下变色的指示剂,可选择酚酞作指示剂,故A正确;
B.B点pH=8,c(H+)=10-8mol/L,c(OH-)=10-6mol/L,B点NaOH与HN3恰好反应生成NaN3,根据质子守恒可得:c(OH-)=c(HN3)+c(H+),则c(HN3)=c(OH-)-c(H+)=(10-6-10-8)mol/L,故B正确;
C.因为A点时,NaOH存在,抑制水的电离,C点时HN3过量,也抑制水的电离,只有B点恰好完全反应,只存在盐类的水解,促进水的电离,所以B点水的电离程度最大,B点后水的电离程度逐渐减小,则曲线A→B→C的过程中,由水电离产生的c(OH-)先增大后减少,故C错误;
D.D点时,加入的HN3的物质的量是NaOH的2倍,溶液呈酸性,则c(OH-)<c(H+),根据电荷守恒c(H+)+c(Na+)=c(N3-)+c(OH-)可知:c(N3-)>c(Na+),结合物料守恒2c(Na+)=c(HN3)+c(N3-)可得:c(N3-)>c(Na+)>c(HN3),故D正确;
答案为C。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】面对新冠肺炎病毒可以采用的消毒剂常见的有“84”消毒液,医用酒精它们的有效成分分别是NaClO、![]() ,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
(1)以上涉及元素包含______个主族、______个周期;按原子半径由小到大排列依次为____________(用元素符号表示);有2个未成对电子元素是______;非金属性:O>Cl,请列举一个事实________________________。
(2)![]() 是______(“电解质”,“非电解质”);75%酒精的“75%”是______(“质量分数分数”,“体积分数”),
是______(“电解质”,“非电解质”);75%酒精的“75%”是______(“质量分数分数”,“体积分数”),![]() 分子中的氢原子的类型有______种(“2”,“3”或“4”)。
分子中的氢原子的类型有______种(“2”,“3”或“4”)。
(3)NaClO的电子式______,其溶液中的离子浓度由大到小顺序__________________。某化学工作者在家自制“84”消毒液如图

(4)①M的化学式______,铁是______极;②请阐述该装置能够制取消毒液的理由:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
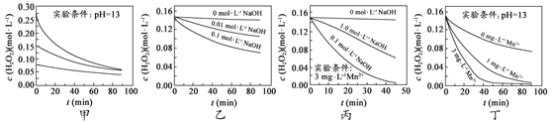
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g) ![]() N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
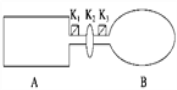
(1)一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”).
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.如图所示,测定中和热时,大小两烧杯间填满碎泡沫的作用是固定小烧杯
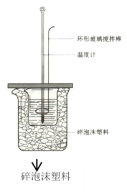
B.若用50mL 0.55mo1·L-1的氢氧化钠溶液,分别与50mL 0.50mo1·L-1的盐酸和50mL 0.50mo1·L-1硫酸充分反应,两反应测定的中和热不相等
C.加入NaOH溶液的正确操作是一次迅速加入
D.若用50mL 0.55mo1·L-1的氢氧化钠溶液与50mL 0.25 mol/L硫酸溶液反应测得中和热,NaOH溶液稍过量是没必要的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以苯乙烯和乙烯为主要原料,设计出医药中间体G的合成路线如图:

已知RCOOH![]() RCOCl
RCOCl![]() RCOOR’。
RCOOR’。
(1)B中含氧官能团的名称为___;D的结构简式为___。
(2)乙烯的某种同系物的化学名称为“甲基丙烯”,则甲基丙烯的结构简式为___。
(3)B能通过分子间脱水生成有机物X,X可用于香料,其结构中含有三个六元环状结构,则B转化为X的化学方程式:___。
(4)M是G的同分异构体,符合下列结构和性质的芳香族化合物M共有___种(不考虑立体异构)。
①1molM与银氨溶液反应最多能得4molAg;
②苯环上有四个取代基,其相对位置为![]() ;
;
③核磁共振氢谱为5组峰,且峰面积为2:2:2:2:1;
④M能发生消去反应。
写出M发生消去反应的化学方程式:___(一例即可)。
(5)设计出以甲苯为原料制备B的合成路线(无机试剂任选,已知:RCHO![]()
![]() ,RCN
,RCN![]() RCOOH)___。
RCOOH)___。
合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物。
目标产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g) ![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的 ΔH________0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B, 反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol氩气,再次达平衡时A的转化率 ________(填“增大”、“减小”或“不变”);
(3)下列选项可作为判断该反应达到平衡的依据是______:
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200 ℃时反应C(g)+D(g) ![]() A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4 kJ·mol-1,在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
2NH3(g)ΔH=-92.4 kJ·mol-1,在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量_________92.4kJ。(填“小于”,“大于”或“等于”)
(2)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是___________。
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将___________(填“正向”、“逆向”或“不”)移动。
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中含有的少量杂质(括号内为杂质),所选试剂不正确的是
A.Cl2(HCl):饱和食盐水、浓硫酸
B.AlCl3溶液(Fe3+):氨水、盐酸
C.C2H2(H2S):CuSO4溶液、碱石灰
D.NaCl溶液(SO42-):BaCO3、盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com