
| A. | 液氨中c(NH4+)与c(NH2-)的乘积总为一定值 | |
| B. | 液氨的电离达到平衡时,c(NH3)=c(NH4+)=c(NH2-) | |
| C. | 只要不加入其它物质,液氨中c(NH4+)与c(NH2-)总是相等 | |
| D. | 液氨中含有NH3、NH4+、NH2-、H2O、NH3•H2O等微粒 |
分析 A.液氨中 c(NH4+)与 c(NH2-)的乘积只与温度有关;
B.液氨与水的电离相似,为微弱电离,所以液氨中主要存在NH3;
C.只要不破坏氨分子的电离平衡,液氨中存在c(NH4+ )=c(NH2-);
D.可逆反应中的各种微粒都共存.
解答 解:A.液氨中c(NH4+)与c(NH2-)的乘积只与温度有关,与溶液的浓度无关,所以只要温度一定,液氨中c(NH4+ )与c(NH2-)的乘积为定值,故A错误;
B.液氨与水的电离相似,为微弱电离,所以液氨中主要存在NH3,所以液氨的电离达到平衡时,c(NH3)>c(NH4+)=c(NH2-),故B错误;
C.根据2NH3?NH4++NH2-知,液氨电离出NH4+、NH2-的个数比为1:1,所以只要不加入其它物质,液氨中c(NH4+)与c(NH2-)总是相等,故C正确;
D.液氨电离中存在电离平衡,所以液氨中含有 NH3、NH4+、NH2-粒子,不含水分子,故D错误;
故选C.
点评 本题考查弱电解质的电离,为高频考点,正确理解弱电解质电离特点是解本题关键,注意液氨中 c (NH4+ )与 c (NH2- )的乘积只与温度有关,与溶液的浓度无关,易错选项是A.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
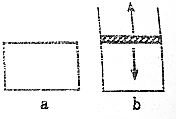 已知2N02?N2O4△H<0.将N02充入容易导热的材料制成的容器a和b中进行反应,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反应同时开始.
已知2N02?N2O4△H<0.将N02充入容易导热的材料制成的容器a和b中进行反应,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反应同时开始.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤①⑥⑦④ | B. | ④⑥①③②⑤⑦ | C. | ④②⑤⑥①③⑦ | D. | ②⑥⑦④③⑤① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验目的 |
| (滴定前的所有操作正确,已略去) 步骤1: ①用碱式滴定管量取20.00mL的氨水放入锥形瓶中,滴入2滴甲基橙. ②用酸式滴定管取0.1000mol/L盐酸滴定氨水. ③当锥形瓶中的溶液由黄色变成橙色时,停止滴定,纪录数据. ④重复滴定操作2~3次. | 测定氨水的准确浓度 |
| 步骤2:用pH计测定氨水的pH. | 测定氨水中c(OH-)浓度 |
| 步骤3:通过实验数据计算氨水的电离常数K | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
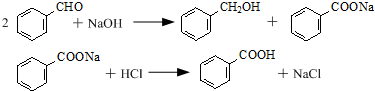
| 名称 | 相对密度 | 熔点(℃) | 沸点(℃) | 溶解度 | |
| 水 | 乙醚 | ||||
| 苯甲醛 | 1.04 | -26 | 179.6 | 微溶 | 易溶 |
| 苯甲酸 | 1.27 | 122.1 | 249 | 25℃微溶,95℃可溶 | 易溶 |
| 苯甲醇 | 1.04 | -15.3 | 205.7 | 微溶 | 易溶 |
| 乙醚 | 0.71 | -116.3 | 34.6 | 不溶 | -- |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com