
硫代硫酸钠在工业生产中用途非常广泛。
(1)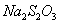 溶液是定量实验中的常用试剂。实验室需用480mL一定浓度的
溶液是定量实验中的常用试剂。实验室需用480mL一定浓度的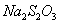 溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒外,还需__________________。
溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒外,还需__________________。
(2)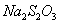 可以用作氰化物的解毒剂,工业上常用硫化碱法制备
可以用作氰化物的解毒剂,工业上常用硫化碱法制备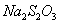 ,反应原理为:
,反应原理为:

某研究小组在实验室模拟该工业原理制备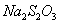 ,部分实验装置如下:
,部分实验装置如下:

①装置B的作用是检验装置A中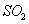 的吸收效率,则B中试剂是________________,
的吸收效率,则B中试剂是________________,
表明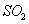 吸收效率低的实验现象是B中溶液________________________。
吸收效率低的实验现象是B中溶液________________________。
②实验结束时,测得装置C中的溶液含有两种溶质,其中一种为NaOH,则实验过程中该装置内发生反应的化学方程式是_________________________;若两种溶质的物质的量相等,则该溶液所含离子浓度的大小顺序为__________________________________。
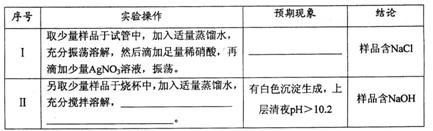
③假设本实验所用的 含少量NaC1、NaOH,设计实验方案进行检验。请完成下表。
含少量NaC1、NaOH,设计实验方案进行检验。请完成下表。
已知:室温时CaCO3饱和溶液的pH=10.2。
限选试剂及仪器:稀硝酸、AgNO3溶液、CaC12溶液、酚酞溶液、蒸馏水、pH计,烧杯、试管、胶头滴管。
科目:高中化学 来源: 题型:
化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol
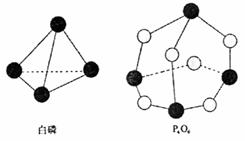 化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ·mol-1)P-P:198 P-O:360 O=O:498则反应P4(白磷)+3O2→P4O6的能量变化为( )
化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ·mol-1)P-P:198 P-O:360 O=O:498则反应P4(白磷)+3O2→P4O6的能量变化为( )
A.释放1638kJ的能量
B.吸收1638kJ的能量
C.释放126kJ的能量
D.吸收126kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+3B(g) 2C(g)+2D(g)在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g)在不同情况下测得反应速率,其中反应速率最快的是
A.υ(A)=0.1 mol ·L-1·s-1 B.υ(B)=0.6 mol ·L-1·s-1
C.υ(C)=0.5 mol ·L-1·s-1 D.υ(D)=0.4 mol ·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
I:已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
T℃时物质的浓度(mol•L-1)变化
| 时间/ min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 ,T℃时该化学反应的平衡常数是 。
在该温度下,若向一容积固定的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和2.0mol H2,则反应向 进行。(填“正反应方向”或“逆反应方向”)
(2)已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol•L-1,则CO在此条件下的转化率为 ,如果保持体积不变向该密闭容器中再充入1 mol氩气,平衡时CO的转化率 (填“变大”“不变”“变小”)
(3)397℃时该反应的平衡常数为12,请判断该反应的△H 0(填“>”、“=”、“<”).
II:工业上可用CO和H2在一定条件下合成甲醇,反应为:
CO(g)+2H2(g)⇌ CH3OH(g)ΔH=Q kJ•mol-1
现在容积均为2L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
 |
(1)该反应的Q 0(选填“<”、“>”或“=”,下同),K1 K2。
(2)300℃时,该反应的平衡常数为 。
(3)将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有:____________
(至少答2种) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
食品抗氧化剂是能阻止或延缓食品氧化变质、提高食品稳定性和延长贮存期的食品添加剂。BHT是一种常用的食品抗氧化剂,合成方法有如下两种:
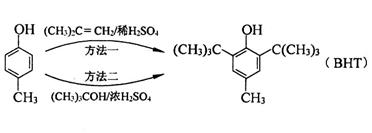
下列说法不正确的是
C.BHT不能与NaHCO3溶液反应生成CO2
D.两种方法的反应类型都是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是
A.原子序数: X<Y B.原子半径:X<Y
C.离子半径:X>Y D.原子最外层电子数:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公
众关注的焦点。铊的相关信息如下图所示,其中“6s26p1”表示铊原子
有6个电子层,最外层有3个电子。下列有关卡片信息解读不正确的是
A.铊的元素符号为Tl B.铊原子的中子数为204
C.铊位于第六周期ⅢA族 D.铊的金属性比铝的金属性强

查看答案和解析>>
科目:高中化学 来源: 题型:
某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,且气体体积为标况体积):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大___________,
原因是 。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体
积的下列溶液,你认为可行的是__________。
A.蒸馏水 B.NaCl溶液 C.NaNO3溶液 D.CuSO4溶液 E.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
要检验溴乙烷中的卤素是不是溴元素,正确的实验方法是 ( )
①加入氯水振荡,观察水是否有红棕色的溴出现
②加入NaOH溶液共热,冷却后加入稀硝酸至酸性,再滴入AgNO3溶液,观察有无浅色沉淀生成
③滴入AgNO3溶液,再加入稀硝酸,观察有无浅黄色沉淀生成
④加入NaOH的醇溶液共热,冷却后加入稀硝酸至酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成
A.①③ B.②④ C.①② D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com