
| A、pH=4的HCl溶液与pH=4的醋酸中c(Cl-)>c(CH3COO-) |
| B、20 mL 0.1 mol?L-1氨水与10 mL 0.1 mol?L-1盐酸的混合溶液中c(NH4+)+c(NH3?H2O)=c(Cl-)+c(OH- ) |
| C、pH=8的0.1 mol?L-1的NaHB溶液中c(HB-)>c(H+)>c(B2-)>c (H2B) |
| D、20 mL 0.1 mol?L-1NaHCO3溶液与10 mL 0.1 mol?L-1NaOH溶液混合后c(HCO3-)+3c(H2CO3)-c(CO32-)=2[c(OH-)-c(H+)] |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

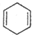 ②CH2=CH2③
②CH2=CH2③ ④CH2=C=CH2.
④CH2=C=CH2.| A、只有③ | B、只有②③ |
| C、只有①②③ | D、有①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  | 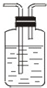 | 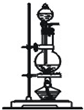 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都不能 | B、都能 |
| C、②④⑤ | D、只有⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1×10-11 mol?L-1,1×10-12 mol?L-1,1×10-8 mol?L-1 |
| B、1×10-11 mol?L-1,1×10-8 mol?L-1,1×10-12 mol?L-1 |
| C、2×10-11 mol?L-1,1×10-10 mol?L-1,1×10-8 mol?L-1 |
| D、1×10-8 mol?L-1,1×10-11 mol?L-1,1×10-12 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该池只能是电解池,且金属铜为该电解池的阳极 |
| B、该池只能是原电池,且电解质溶液为硝酸 |
| C、该池可能是原电池,也可能是电解池 |
| D、该池只能是电解池,电解质溶液可以是硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe+CuSO4=Cu+FeSO4 | ||||
| B、AgNO3+NaCl=AgCl↓+NaNO3 | ||||
C、3CO+Fe2O3
| ||||
D、MgCl2(熔融)
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com