
【题目】下图分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:
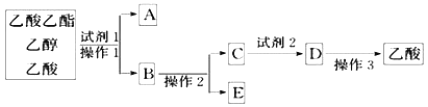
(1)试剂1最好选用_______;
(2)操作1是_______;
(3)试剂2最好选用_______;
(4)操作2是_______;
 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.747 5 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为[已知:K2Cr2O7+6FeSO4+7H2SO4=K2SO4+Cr2(SO4)3+3Fe2(SO4)3+7H2O]( )
A. 1∶1B. 2∶1C. 3∶1D. 2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中错误的是
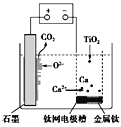
A. 在制备金属钛前后,整套装置中CaO的总量保持不变
B. 阳极的电极反应式为C+2O2--4e-===CO2↑
C. 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol 电子
D. 若用铅蓄电池作供电电源,“—”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家在合成氨(N2+3H2![]() 2NH3 △H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理,如图所示。下列说法不正确的是( )
2NH3 △H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理,如图所示。下列说法不正确的是( )
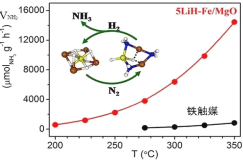
A.过程中有极性键形成
B.复合催化剂降低了反应的活化能
C.复合催化剂能降低合成氨反应的焓变
D.350℃,催化效率:5LiH-Fe/MgO>铁触媒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期科学家报告了一种直接电化学合成H2O2的方法,装置如图。下列叙述不正确的是( )
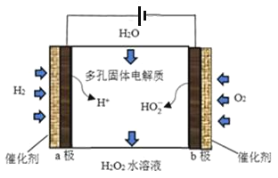
A.该装置的工作原理是将化学能转化成电能
B.b极发生的电极反应为O2+H2O+2e-=HO2-+OH-
C.电池工作时,内部发生反应:HO2-+OH-+2H+=H2O2+H2O
D.电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3.15晚会中曝光一种劣质净水机的欺骗推销手段:销售人员用如图所示“验水器”检验居民家庭自来水,接通电源后自来水产生大量深色絮状沉淀,而净化后的水再用同一个“验水器”检验,再次接通电源后水没有明显变化依然澄清透明。关于该实验下列分析正确的是( )

A.净化水导电能力理论上比自来水强
B.两次通电可能通过开关反转正负极
C.两次通电的阴极反应产生气体不同
D.金属电极可能采用的是铝或铁材质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应,H2O只作还原剂的是
A.2H2O![]() 2H2↑+O2↑B.2F2+2H2O=4HF+O2
2H2↑+O2↑B.2F2+2H2O=4HF+O2
C.CaO+ H2O=Ca(OH)2D.2Na2O2+2H2O=4NaOH+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是__________(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②再通入CO___________。
(5)该反应的逆反应速率随时间变化的关系如下图:

①从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)___________。(单选)
A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~ t5时间段反应处于新平衡状态,请在图上画出t3~ t5的V(逆)变化曲线______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列编号代表元素周期表中的一部分元素,用化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | ⑦ | ⑧ | |||||
三 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
四 | ② | ④ |
(1)①、③、⑤的最高价氧化物的水化物碱性由强到弱顺序为___________(填化学式,下同)。
(2)②、③、④形成的简单阳离子半径由大到小的顺序是______________。
(3)⑨和⑩的最高价氧化物对应的水化物化学式为_______和_________。①在氧气中点燃生成淡黄色的固体,该固体的电子式为_______________,①能够与水剧烈反应,请写出该反应的化学方程式_______________,将元素⑩的单质通入NaBr溶液中,反应的离子方程式为_______________。
(4)⑥、⑦、⑧三种元素形成的气态氢化物的稳定性排序是____________(填化学式,下同),三种元素非金属性由强到弱的顺序为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com