
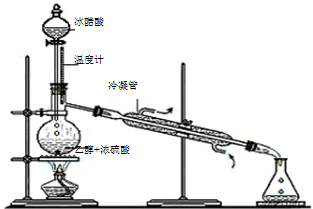
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题:
⑴在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入__________,目的是__________。
⑵反应中加入过量乙醇,目的是__________________________。
⑶如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加乙酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是________
_ _____________________________________________。
⑷现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物,下列框图是分离操作步骤流程图:
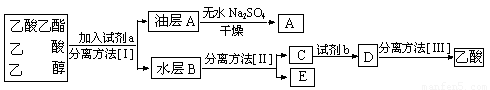
则试剂a是:____________,分离方法III是______________。
⑸甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液,中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人实验结果如下:
甲得到了显酸性的酯的混合物;
乙得到了大量水溶性的物质;
丙同学分析了上述实验目标产物后,认为上述实验都没有成功。
试解答下列问题:
①甲实验失败的原因是_______________________________________________。
②乙实验失败的原因是_______________________________________________。
(1)碎瓷片 ;防止暴沸 (2)提高乙酸的转化率
(3)及时地蒸出生成物,有利于酯化反应向生成酯的方向进行
(4)a :饱和Na2CO3溶液; III :蒸馏
(5)①所加的NaOH溶液较少,没有将余酸中和
②所加的NaOH溶液过量使酯完全水解。
【解析】(1)由于反应需要加热,为防止液体受热时暴沸,需要加热碎瓷片。
(2)酯化反应属于可逆反应,因此为提高乙酸的转化率,需加热过量的乙醇。
(3)因为反应属于可逆反应,因此及时把乙酸乙酯分离出来,可使反应向正反应方向进行,提高原料额度利用率。
(4)为降低乙酸乙酯的溶解度,除去乙酸和溶解乙醇,可利用饱和Na2CO3溶液,提高分液进行分离。即油层A中是乙酸乙酯,水层B是碳酸钠、乙醇和乙酸钠的混合液。将水层B通过蒸馏即得到乙醇和碳酸钠、乙酸钠的混合液。即C为碳酸钠和乙酸钠的混合液,然后加入硫酸即得到乙酸,最后通过蒸馏即得乙酸。
(5)甲得到了显酸性的酯的混合物,说明酸仍有剩余,即所加的NaOH溶液较少,没有将余酸完全中和;乙得到了大量水溶性的物质,说明酯完全水解了,因此只能是所加的NaOH溶液太多,造成了酯在碱性条件下完全水解变成了乙酸钠和乙醇。


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 实验室合成乙酸乙酯的步骤如下:在园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
实验室合成乙酸乙酯的步骤如下:在园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 有机化学知识在生活中应用广泛.
有机化学知识在生活中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
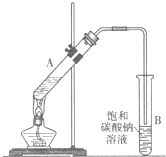 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.| 乙酸 | 乙醇 | 乙酸乙酯 | 乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
| 浓硫酸 |
| ℃140 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com