
(每空1分,共15分)利用“化学计量在实验中的应用”的相关知识进行填空
(1)0.2 mol NH3气体中含的NH3分子数是 ,其中含氢原子数是 ,含有电子的物质的量是 .
(2)1摩尔Ba(OH)2固体中含有的Ba2+的个数是 ,全部溶于水,电离产生的OH-的物质的量是 mol,通入二氧化碳气体,恰好完全反应,消耗的二氧化碳的物质的量是 摩尔。
(3)H2SO4的摩尔质量是 ,49gH2SO4中含有 mol氧原子,含有氢的质量是 。能与 摩尔NaOH恰好完全反应,生成水的质量是 克。
(4)含有6.02×1023个氧原子的H3PO4的物质的量是_________
(5)与标准状况下VLCO2所含氧原子数目相同的水的质量是_______(用分式表示)
(6)将4 g NaOH溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度为__________________
(7)在一定的温度和压强下,1体积X2 (g)跟3体积Y2 (g)化合生成2体积化合物,则该化合物的化学式是_______________
(1)0.2NA;0.6NA;2mol; (2)NA;2;1; (3)98g/mol;2;1g;1;18; (4)0.25mol;
(5)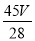 g;(6)0.1mol/L;(7)XY3.
g;(6)0.1mol/L;(7)XY3.
【解析】
试题解析:(1)0.2mol NH3气体中含的NH3分子数是0.2mol×NA mol-1 =0.2NA,一个氨气分子含有3个氢原子,氢原子数为3×0.2NA=0.6NA,一个氨气分子含10个电子,物质的量为0.2mol×10=2mol;(2)1摩尔Ba(OH)2固体含有1molBa2+,因此Ba2+的个数是NA,全部电离可电离出氢氧根离子2mol,根据CO2+2OH-=CO32-+H2O可知,2molOH-消耗1mol的CO2;(3)H2SO4的相对分子质量为98,其摩尔质量为98g/mol,49gH2SO4的物质的量为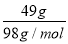 =0.5mol,含有氧原子为0.5mol×4=2mol,氢原子为0.5mol×2=1mol,1molH的质量为1mol×1g/mol=1g,根据H2SO4 +2NaOH=Na2SO4+2H2O可知,0.5mol硫酸可以中和1molNaOH,同时生成1molH2O,1molH2O的质量为1mol×18g/mol=18g;(4)6.02×1023个氧原子,即氧原子的物质的量是1mol,所以H3PO4的物质的量是0.25mol;(5)标准状况下VLCO2的物质的量为
=0.5mol,含有氧原子为0.5mol×4=2mol,氢原子为0.5mol×2=1mol,1molH的质量为1mol×1g/mol=1g,根据H2SO4 +2NaOH=Na2SO4+2H2O可知,0.5mol硫酸可以中和1molNaOH,同时生成1molH2O,1molH2O的质量为1mol×18g/mol=18g;(4)6.02×1023个氧原子,即氧原子的物质的量是1mol,所以H3PO4的物质的量是0.25mol;(5)标准状况下VLCO2的物质的量为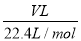 =
=
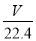 mol,氧原子的物质的量等于二氧化碳的2倍,氧原子物质的量为
mol,氧原子的物质的量等于二氧化碳的2倍,氧原子物质的量为 mol=
mol=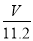 mol,含有相等氧原子的水的物质的量为
mol,含有相等氧原子的水的物质的量为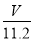 mol,故水的质量为
mol,故水的质量为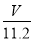 mol×18g/mol=
mol×18g/mol=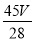 g;(6)令稀释后氢氧化钠溶液的浓度为c,根据稀释定律,稀释前后溶质的质量不变,则:c×1L×40g/mol=4g,解得:c=0.1
g;(6)令稀释后氢氧化钠溶液的浓度为c,根据稀释定律,稀释前后溶质的质量不变,则:c×1L×40g/mol=4g,解得:c=0.1
mol/L;(7)一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物,设该化合物为Z,由气体的体积之比等于物质的量之比,等于化学计量数之比,则X2+3Y2═2Z,由原子守恒可知,Z为XY3。
考点:物质的量的相关计算


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源:2014-2015学年河南省洛阳市高二10月月考化学试卷(解析版) 题型:选择题
在温度和容积不变的容器中,一定条件下发生下列变化:H2(g)  2H(g)(气态氢原子)。ΔH >0。当容器中H2的浓度从0.1mol/L变为0.06mol/L时,需20秒,那么H2的浓度由0.06mol/L下降到0.036mol/l时需时间:( )
2H(g)(气态氢原子)。ΔH >0。当容器中H2的浓度从0.1mol/L变为0.06mol/L时,需20秒,那么H2的浓度由0.06mol/L下降到0.036mol/l时需时间:( )
A.12秒 B.无法判断 C.大于12秒 D. 小于12秒
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省汝州市高二上学期第一次月考化学试卷(解析版) 题型:选择题
以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=-Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=-Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=-Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是 ( )
A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省西区高一9月月考化学试卷(解析版) 题型:选择题
下图所示四种化学操作名称从左到右分别为

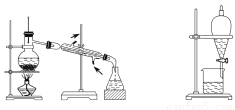
A.过滤、蒸发、蒸馏、萃取(或分液或萃取、分液) B.过滤、蒸馏、蒸发、萃取
C.蒸发、蒸馏、过滤、萃取 D.萃取、蒸馏、蒸发、过滤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省西区高一9月月考化学试卷(解析版) 题型:选择题
已知乙酸乙酯(C4H8O2)是一种无色液体,不溶于水,密度小于1 g·mL-1,沸点约为55 ℃。要从水与乙酸乙酯的混合物中将乙酸乙酯分离出来,下列方法中最简便的是( )
A.蒸馏 B.分液 C.过滤 D.蒸发
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高一10月月考化学试卷(解析版) 题型:选择题
下列说法中错误的是 ( )
A.从1L 1mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L
B.制成0.5L 10mol/L的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10g 98%的硫酸(密度为1.84 g/cm3)与10 mL 18.4 mol/L硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省新郑市高一上学期期中学业水平测试化学试卷(解析版) 题型:填空题
(11分)(1)现有同温同压下的0.3mol SO2和0.2mol CO2 ,两者的质量比为 ;所含原子个数比为 ;密度比为 ;
(2)有一金属氯化物MCl2 27g , 含有0.40molCl-, 则该氯化物的物质的量为 , 其摩尔质量为 ,金属M的相对原子质量为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省新郑市高一上学期期中学业水平测试化学试卷(解析版) 题型:选择题
下列变化,需要加入适当的氧化剂才能完成的是( )
A.PCl3→PCl5 B.MnO4- →Mn2+
C.SO2 →SO32- D.FeCl3→FeCl2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高二10月月考化学试卷(解析版) 题型:填空题
(16分)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.3 ℃ |
|
② | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com