
| A.Al3+、NO3―、K+、SO42ˉ | B.Ca2+、H+、CO32ˉ、AlO2- |
| C.OHˉ、SO42ˉ、NH4+、Al3+ | D.K+、Ca2+、HCO3-、OH- |
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.含有 NH4+、Cl-、H+、OH-的溶液中,其离子浓度可能是c(Cl-)> c(NH4+)>c(OH-)>c(H+) |
| B.常温下pH=6的醋酸与醋酸钠的混合溶液中c(Na+)>c(CH3COO-) |
| C.0.1 mol·L-1的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D.常温下pH=3的一元酸和pH=11的一元碱等体积混合后的溶液中一定是c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入铝粉有氢气产生的溶液中Na+、K+、SO42-、Cl-、HCO-3 |
| B.含有大量硝酸根离子的溶液中H+、Fe2+、SO42-、Cl- |
| C.常温下,c(H+)/c(OH-) = 1×10-10的溶液中NH4+、K+、Ca2+、Cl- |
| D.常温下pH=1的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| C.pH=11的NaOH的溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色 |
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中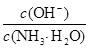 增大 增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- |
| B.c(H+)/c(OH-)=10-10的溶液:K+、Ba2+、NO3-、Cl- |
| C.pH=0的溶液:Al3+、Ag(NH3) 2-、Cl-、SO42- |
| D.c(ClO-)=1.0 mol·L-1的溶液:Na+、SO32-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入铝条有氢气放出的溶液:Na+、NH4+、HCO3-、NO3- |
| B.使pH试纸显深蓝色的溶液:Cu2+、NO3-、Fe3+、SO42- |
| C.由水电离产生的c(OH-)=1×10-14mol/L的溶液:Ba2+、Na+、NO3-、Cl- |
| D.所含溶质为Na2SO4的溶液:K+、SiO32-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
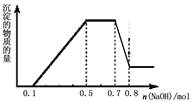
| A.溶液中一定不含CO32?,可能含有SO42?和NO3? |
| B.在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3++4OH-=[Al(OH)4 ]- |
| C.溶液中的阳离子只有H+、Mg2+、Al3+ |
| D.n(H+)∶n(NH4+)∶n(Mg2+) =2∶4∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- |
| B.无色溶液中:Mg2+、MnO4-、SO42-、K+ |
| C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.c(ClO-)=" 1.0" mol/L的溶液:Na+、SO32-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH4+ |
| 阴离子 | OH-、NO3—、I-、HCO3—、AlO2—、HSO4— |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com