
| A. | 1 mol | B. | 5 mol | C. | 6 mol | D. | 2 mol |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若(a+b)<(c+d),则反应一定能自发向右进行 | |
| B. | 若从正反应开始,起始时A、B的物质的量之比为a:b,则平衡时A、B的转化率之比也为a:b | |
| C. | 若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n mol B,则达到平衡时气体总物质的量大于(m+n)mol | |
| D. | 若a+b=c,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$ +H2O
+H2O 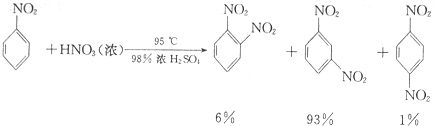
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| B. | 具有相同通式的有机物不一定互为同系物 | |
| C. | 含有相同官能团,且相对分子量相差14的有机物一定互为同系物 | |
| D. | 互为同系物的有机物,其化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 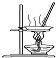 用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. |  图装置可用于收集H2、NH3、NO等气体 | |
| C. | 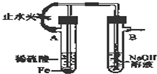 图装置能较长时间观察到Fe(OH)2白色沉淀 | |
| D. |  图能比较MnO2、Cl2、I2的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要使AlCl3溶液中Al3+全部沉淀出来可使用氨水 | |
| B. | 要检验某溶液中是否含Fe3+可加入铁粉 | |
| C. | 新制的氯水中可用PH试纸准确测定其PH值 | |
| D. | 某气体能使品红溶液褪色,该气体一定为SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
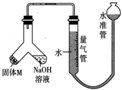 某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装置进行实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com