
| A. | 2-丁烯与HBr发生加成反应 | |
| B. | 3-氯戊烷与NaOH乙醇溶液共热发生消去反应 | |
| C. | 甲苯在一定条件下发生溴代反应生成一溴代甲苯的反应 | |
| D. | 邻羟基苯甲酸与NaHCO3溶液反应 |
分析 A、2-丁烯的双键两边对称,据此判断和HBr加成的产物;
B、3-氯戊烷的氯原子相连的碳原子两边的结构是对称的,氯原子消去的氢原子是对称的;
C、甲苯在一定条件下发生取代反应,苯环上甲基的邻、间、对位置上的氢原子都可以被取代;
D、邻羟基苯甲酸中的羧基可以和碳酸氢钠之间反应得到羧酸钠、水和二氧化碳.
解答 解:A、2-丁烯的双键两边对称,和HBr加成的产物只有一种2-溴丁烷,故A不选;
B、3-氯戊烷的氯原子相连的碳原子两边的结构是对称的,氯原子消去的氢原子是对称的,消去得到的产物是一种,为2-戊烯,故B不选;
C、甲苯在一定条件下发生取代反应,苯环上甲基的邻、间、对位置上的氢原子都可以被取代,甲苯在一定条件下发生溴代反应生成一溴代甲苯的产物不止一种,存在同分异构体,故C选;
D、邻羟基苯甲酸中的羧基可以和碳酸氢钠之间反应得到羧酸钠、水和二氧化碳,产物不存在同分异构体,故D不选.
故选C.
点评 本题以加成反应、取代反应、消去反应为载体,考查同分异构体、常见有机物的性质等,掌握加成反应与消去反应的反应原理是解题的原理.


科目:高中化学 来源: 题型:实验题

| 操作步骤 | 实验现象 | 解释原因 |
 | 滴加硝酸银溶液,现象有:产生白色沉淀 | 原因有:氯气与水反应后,电离出Cl-,Cl-与Ag+生成AgCl白色沉淀 |
 | 滴加紫色石蕊试液,现象有:先变红,后褪色 | 原因有:氯气与水反应后,溶液显酸性使紫色石蕊试液变红,产生的HClO又使红色的石蕊试液发生漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
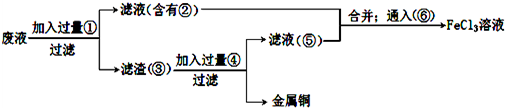
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [Cr(H2O)6]Cl3 | B. | [Cr(H2O)5Cl]Cl2•H2O | ||
| C. | [Cr(H2O)4Cl2]Cl•2H2O | D. | [Cr(H2O)3Cl3]•3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
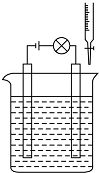 实验探究离子之间是否发生了反应.
实验探究离子之间是否发生了反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所用的酸过量 | B. | 生成的盐不水解 | ||
| C. | 酸与碱等物质的量混合 | D. | 反应后溶液中c(A-)=c(M+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com