
| A. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| B. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 | |
| D. | I-I键的键能比F-F、Cl-Cl、Br-Br键的键能都小;则在卤素单质中碘的熔点最低 |
分析 A、元素的非金属性越强,则氢化物的稳定性越强;
B、当物质的结构相似时,相对分子质量越大,则熔沸点越高;氨气分子间存在氢键;
C、金属晶体中只有阳离子,无阴离子;
D、化学键的键能影响物质的化学性质,与物理性质无关.
解答 解:A、元素的非金属性越强,则氢化物的稳定性越强.由于第二周期的非金属性F>O>N,故氢化物的稳定性顺序是HF>H2O>NH3;第3周期元素的非金属性为Cl>S>P,故氢化物的稳定性顺序也是:HCl>H2S>PH3,故A正确;
B、GeH4、SiH4、CH4分子间均无氢键,而当物质的结构相似时,相对分子质量越大,则熔沸点越高,故熔沸点顺序为GeH4>SiH4>CH4;由于氨气分子间存在氢键,使熔沸点反常的升高,故熔沸点为NH3>AsH3>PH3,故B错误;
C、金属晶体中只有阳离子,无阴离子,故晶体中含阳离子时,不一定含阴离子,但含阴离子时,一定含阳离子,故C错误;
D、化学键的键能影响物质的化学性质,与物理性质无关,分子晶体的熔沸点与相对分子质量成正比,碘分子的相对分子质量比氟气、氯气和溴的大,所以其熔沸点最高,故D错误;
故选A.
点评 本题考查元素周期律的应用和分子间作用力、氢键对物质的熔沸点的影响,注意利用实例分析选项,把握特殊物质中的化学键影响物质的化学性质,而分子间作用力和氢键影响物理性质,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液和CuCl2溶液 | B. | Na2SO4溶液和NaCl溶液 | ||
| C. | AlCl3溶液和NaOH溶液 | D. | 盐酸溶液和Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )
在元素周期表中所示氮元素如图.化学家在研究人工固氮的过程中使用了N3-,下列对于N3-的说法中不正确的是( )| A. | N3-是氮元素的一种新单质 | B. | N3-是带1个单位负电荷的阴离子 | ||
| C. | N3-的相对质量约为42 | D. | 1个N3-中有21个质子和22个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Cl2不存在同分异构体是甲烷正四面体结构的理由之一 | |
| B. | 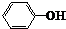 和 和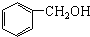 互为同系物 互为同系物 | |
| C. |  的系统命名的名称是1,2-二溴-2-环己烯 的系统命名的名称是1,2-二溴-2-环己烯 | |
| D. | 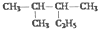 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳在氧气中的燃烧 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 锌粒与稀H2SO4反应制取H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷的比例模型是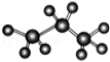 | |
| B. | C2H4 与C3H6一定互为同系物 | |
| C. | 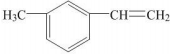 属于芳香烃 属于芳香烃 | |
| D. | 羟基的电子式为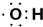 ,1 mol-OH 含有7 mol 电子 ,1 mol-OH 含有7 mol 电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| (1) | 0.3mol | 0.2mol | 0.1mol | ╱ |
| (2) | 0.1mol | 0.3mol | ╱ | 0.1mol |
| A. | 各种离子的浓度均相同 | B. | 只有c(K+)相同 | ||
| C. | 各种离子的浓度均不同 | D. | 只有c(Zn2+)相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com