
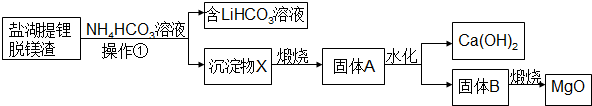
分析 盐湖提锂脱镁渣主要成分为Mg(OH)2、Li2CO3和少量CaCO3,加NH4HCO3,过滤,滤液含有LiHCO3,滤渣含有MgCO3和少量CaCO3,煅烧滤渣MgCO3、CaCO3分解生成固体A中含有MgO、CaO,加水,CaO转化为氢氧化钙,固体B为MgO和Mg(OH)2,煅烧固体B得到MgO;
(1)根据流程分析;
(2)固体A中MgO在真空、1200℃条件下与硅单质反应生成金属镁和二氧化硅;
(3)Mg(OH)2与NH4HCO3反应生成Mg5(CO3)4(OH)2•4H2O和氨水;
(4)Li2CO3与NH4HCO3反应消耗NH4HCO3;
(5)若煅烧不完全会含有碳酸根,碳酸盐加盐酸会产生二氧化碳气体.
解答 解:盐湖提锂脱镁渣主要成分为Mg(OH)2、Li2CO3和少量CaCO3,加NH4HCO3,过滤,滤液含有LiHCO3,滤渣含有MgCO3和少量CaCO3,煅烧滤渣MgCO3、CaCO3分解生成固体A中含有MgO、CaO,加水,CaO转化为氢氧化钙,固体B为MgO和Mg(OH)2,煅烧固体B得到MgO;
(1)由流程分析可知,固体A的成分是MgO、CaO;
故答案为:MgO、CaO;
(2)固体A中MgO在真空、1200℃条件下与硅单质反应生成金属镁和二氧化硅,其反应方程式为:2MgO+Si$\frac{\underline{\;\;△\;\;}}{\;}$2Mg+SiO2;
故答案为:2MgO+Si$\frac{\underline{\;\;△\;\;}}{\;}$2Mg+SiO2;
(3)Mg(OH)2与NH4HCO3反应生成Mg5(CO3)4(OH)2•4H2O和氨水,其反应的方程式为:5Mg(OH)2+4NH4HCO3=Mg5(CO3)4(OH)2•4H2O+4NH3•H2O;
故答案为:5Mg(OH)2+4NH4HCO3=Mg5(CO3)4(OH)2•4H2O+4NH3•H2O;
(4)实际生产中NH4HCO3与Mg(OH)2等物质的量之比要比(3)中反应理论值大,是因为除了发生(3)中反应外,Li2CO3与NH4HCO3反应消耗NH4HCO3;
故答案为:反应生成LiHCO3需要消耗NH4HCO3;
(5)若煅烧不完全会含有碳酸根,碳酸盐加盐酸会产生二氧化碳气体,检验操作为:取少量煅烧后的沉淀物X,加入稀盐酸,观察是否有气体生成,若有气体生成,说明煅烧不充分;
故答案为:取少量煅烧后的沉淀物X,加入稀盐酸,观察是否有气体生成,若有气体生成,说明煅烧不充分.
点评 本题考查了物质分离和提纯操作的综合应用,题目难度中等,注意把握混合物分离试剂作用和生成产物判断、实验流程分析等,答题时注意元素守恒的应用及化学用语的规范表达.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:解答题
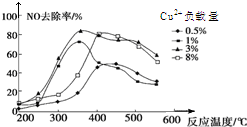 雾霾严重影响人们的生活,汽车尾气的排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:
雾霾严重影响人们的生活,汽车尾气的排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂在NaOH热溶液中完全水解后,加入热饱和食盐水可观察到液面上有固体析出 | |
| B. | 容量瓶、滴定管和分液漏斗均标有“O”刻度线,使用前均需要检漏 | |
| C. | 实验室用二氧化锰与浓盐酸制氯气时,先加热二氧化锰再滴加浓盐酸 | |
| D. | 为检验摩尔盐中的NH4+,可向试样加入少量的稀Na0H,再用pH试纸检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

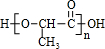 .
.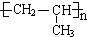 ,该反应类型是加聚反应.
,该反应类型是加聚反应.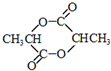 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验开始时应先加热后通冷凝水 | |
| B. | 不能用湿润的pH试纸测定溶液的pH,否则必然会使实验结果产生误差 | |
| C. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)应过量 | |
| D. | 在中和热测定实验中,为准确测得反应前后的温差,应将已分别测得温度的氢氧化钠溶液与盐酸在量热剂中快速混合,并不断轻轻搅拌,测量混合液的最高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐可做食物调味剂,也可做食品防腐剂 | |
| B. | 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性 | |
| C. | 海水淡化的方法主要有蒸馏法、离子交换法等 | |
| D. | 通常所说的三大合成材料是指塑料、合成橡胶和合成纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
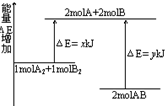
| A. | 该反应是吸热反应 | |
| B. | 断裂1molA-A键和1molB-B键共可放出xKJ能量 | |
| C. | 断裂1molA-B键需要吸收yKJ能量 | |
| D. | 1molA2和1molB2完全反应生产2molAB,放出(y-x)KJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com