
分析 (1)相对分子质量:CaCO3是100、MgCO3是84、Mg(OH)2是58,三都中碳酸钙的分子量最大,也就是如果2.9克固体全部碳酸钙时,物质的量最少消耗的盐酸的物质的量也最小,由关系式:
CaCO3~2HCl
1 2
$\frac{2.9}{100}$ $\frac{2.9}{50}$mol
,而为保证固体全部溶解,所以氢氧化镁消耗酸的能力最强,如果2.9克固体全部氢氧化镁时,全然后求盐酸的物质的量浓度的最小值,然后根据两个最小值,综合分析;
(2)得到0.03 mol CaCO3沉淀,需要CO2的质量=0.03×44=1.32g,则生成水的质量=2.89-1.48-1.32=0.09克
氢氧化镁的质量=$\frac{0.09}{18}×58$=0.29克
则碳酸盐的质量=2.89-0.29=2.6克
假定都是碳酸钙,生成1.32克CO2,需要碳酸钙的质量=$\frac{1.32}{44}×100$=3g,与原始质量相比得出结论;
(3)设有碳酸钙X克,能生成CO2Y克,最后求出水垢中CaCO3的质量分数.
解答 解:(1)相对分子质量:CaCO3是100、MgCO3是84、Mg(OH)2是58,三都中碳酸钙的分子量最大,也就是如果2.9克固体全部碳酸钙时,物质的量最少消耗的盐酸的物质的量也最小,由关系式:
CaCO3~2HCl
1 2
$\frac{2.9}{100}$ $\frac{2.9}{50}$mol
所以盐酸的物质的量浓度大于$\frac{\frac{2.9}{50}}{0.04}$=1.45mol/L,
而为保证固体全部溶解,所以氢氧化镁消耗酸的能力最强,如果2.9克固体全部氢氧化镁时,
Mg(OH)2~2HCl
58g 2mol
2.9g 0.1mol,
所以盐酸的物质的量浓度大于$\frac{0.1}{0.04}$=2.5mol/L,综上所述为保证固体全部溶解,并使二氧化碳全部逸出,盐酸的浓度应大于2.5mol/L,
故答案为:2.5;
(2)得到0.03 mol CaCO3沉淀,需要CO2的质量=0.03×44=1.32g,则生成水的质量=2.89-1.48-1.32=0.09克
氢氧化镁的质量=$\frac{0.09}{18}×58$=0.29克
则碳酸盐的质量=2.89-0.29=2.6克
假定都是碳酸钙,生成1.32克CO2,需要碳酸钙的质量=$\frac{1.32}{44}×100$=3g,所以有碳酸镁和氢氧化镁,故答案为:假定都是碳酸钙,生成1.32克CO2,需要碳酸钙的质量=$\frac{1.32}{44}×100$=3g,而质量只有2.89g,所以有碳酸镁和氢氧化镁;
(3)设有碳酸钙X克,能生成CO2Y克
则有碳酸镁2.6-X,能生成CO21.32-Y
CaCO3~~~~~CO2
100 44
X Y
44X=100Y
MgCO3~~~~~CO2
84 44
2.6-X 1.32-Y
44×(2.6-X)=84×(1.32-Y)
解得
X=0.5克
水垢中CaCO3的质量分数为$\frac{0.5}{2.89}×100%$=17.3%,答:水垢中CaCO3的质量分数为17.3%..
点评 本题考查了混合组成的分析判断的有关计算,明确物质之间的反应结合方程式来分析解答,注意根据反应方程式及结合关系式进行计算,题目难度较大.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:填空题

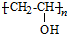 、CH3CH2CH2CHO.
、CH3CH2CH2CHO. .
.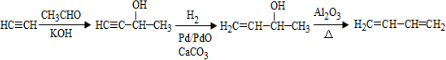 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0225 mol/(L•min) | B. | 0.05 mol/(L•min) | ||
| C. | 0.045 mol/(L•min) | D. | 0.01 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液的物质的量浓度/mol•L-1 | 电离度/% | H+的物质的量浓度/mol•L-1 | pH |
| 0.1 | 2α | c1 | x |
| c | α | 2c1 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g | B. | 47g | C. | 54g | D. | 94g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
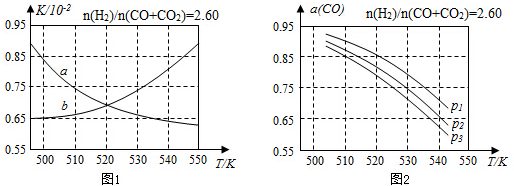
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com